Скорость реакции – это изменение концентрации вещества в единицу времени (при постоянном объеме реакционной смеси), т.е.
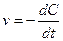 (первая производная молярной концентрации исходного вещества по времени).
(первая производная молярной концентрации исходного вещества по времени).
Знак минус нужен потому, что концентрация исходного вещества уменьшается, а скорость должна быть неотрицательной.
Закон действующих масс: скорость реакции пропорциональна концентрациям реагентов, взятым в некоторых степенях. Если реакция элементарная (т.е. идет именно так, как она записана), то эти степени совпадают с коэффициентами в реакции:
например, для реакции aA + bB = cC + dD скорость v = k · CAa · CBb, где k – некоторый коэффициент, зависящий от температуры:
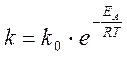 (уравнение Аррениуса)
(уравнение Аррениуса)
Где EA – т.н. энергия активации (та кинетическая энергия, которой должна обладать молекула, чтобы, столкнувшись с другой, она не просто отлетела, а прореагировала), R – универсальная газовая постоянная, T – температура (в K).
Катализатор – вещество, ускоряющее реакцию. Ингибитор – вещество, замедляющее ее. Сами они в процессе реакции не расходуются, хотя и участвуют в ней. Например, вместо реакции A + B = C просходит A + K = AK, а потом AK + B = C +K (схематично).
Биологические катализаторы называются ферментами.
 2014-02-24
2014-02-24 472
472








