Азотные удобрения. Производство нитрата аммония и карбамида
Производство двойного суперфосфата.
Двойной суперфосфат – концентрированное безбалластное фосфорное удобрение, для производства которого можно использовать и бедные фосфориты, содержащие менее 20% P2O5.
Двойной суперфосфат получают разложением природных фосфатов фосфорной кислотой по следующей реакции:
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2 + Q
Двойной суперфосфат получают из фосфоритов по камерному способу. При камерном способе фосфориты обрабатывают 45-50% фосфорной кислотой.
После смешения измельчённого природного фосфата с фосфорной кислотой кристаллизуется моногидрат дигидрофосфата кальция и происходит схватывание и затвердевание реакционной массы.
Этот процесс протекает в камере вызревания за 1-1,5 часа, а завершение кристаллизации и формирования кристаллов при дозревании двойного суперфосфата - на складе.
Азотные удобрения могут содержать азот в форме ионов NH4+ (аммиачная форма), NO3- (нитратной форме), NH2 (амидной форме), либо одновременно в аммиачной и нитратной форме. В соответствии с этим различают следующие виды азотных удобрений: аммиачные, нитратные, амидные и аммонийнонитратные.
Нитрат аммония (аммонийная селитра) NH4NO3 – безбалластное твёрдое удобрение, содержащее 35% азота в аммиачной и нитратных формах, благодаря чему может применяться на любых почвах и для любых культур.
Вследствие высокой растворимости в воде, гигроскопичности и полиморфности превращений (может существовать в пяти кристаллических модификациях, различающихся плотностью и структурой кристаллов), сопровождающихся выделением тепла, нитрат аммония легко слёживается.
Для уменьшения слёживаемости, которая затрудняет использование продукта, в промышленности используют следующие меры:
- выпускают товарный продукт в гранулированном виде, обрабатывая поверхность гранул ПАВ, образующими на них гидрофобную плёнку;
- вводят в состав продукта кондиционирующие добавки, в виде нитрата магния и других солей, которые связывают свободную воду и препятствуют переходу одной модификации в другую.
Химическая и принципиальная схема получения нитрата аммония.
Нитрат аммония получается путём непосредственной нейтрализации азотной кислоты аммиаком с последующим выделением продукта в виде безводной соли.
Нейтрализация азотной кислоты аммиаком – это необратимый, гетерогенный процесс, протекающий с выделением тепла по уравнению:
HNO3 + NH3 = NH4NO3 + Q
Реакция нейтрализации сильно экзотермична, и её теплоту полезно используют для испарения воды из полученного раствора нитрата аммония.
Производство нитрата аммония состоит из трёх стадий:
1-я стадия: синтез нитрата аммония путём нейтрализации разбавленной азотной кислоты газообразным аммиаком;
2-я стадия: выпаривание раствора нитрата аммония;
3-я стадия: кристаллизация и гранулирование плава.
Технологическая схема производства нитрата аммония.
Наиболее распространены технологические схемы с частичным упариванием раствора нитрата аммония за счёт теплоты нейтрализации с использованием 50-58% азотной кислоты (Рис. 6.6):
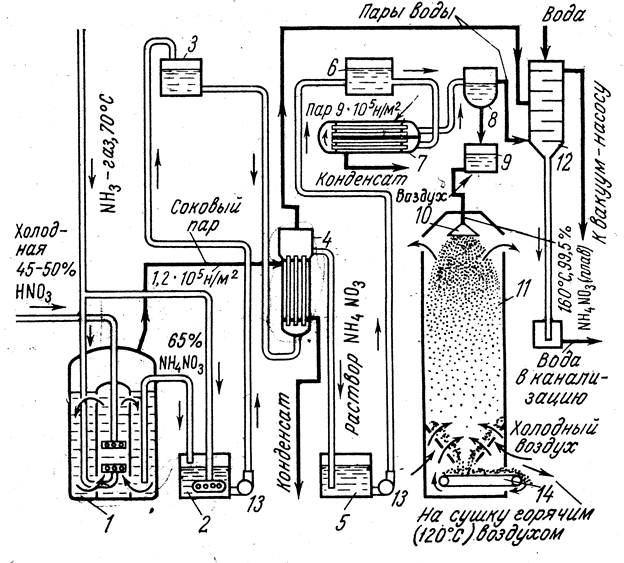
Рис. 6.6. Упрощённая схема производства аммиачной селитры: 1 - нейтрализатор ИТН; 2 - донейтролизатор; 3, 5, 6, 9 - сборники; 4 - выпарной аппарат первой ступени с пароотделтелем; 7 - выпарной аппарат второй ступени; 8 - пароотделитель; 10 - разбрызгиватель плава; 11 - грануляционная башня; 12 - барометрический конденсатор; 13 - центробежные насосы, 14 - ленточный транспортёр.
Нейтрализацию проводят в химическом реакторе, который называется - нейтрализатор ИТН (использование теплоты нейтрализации).
Нейтрализатор ИТН - цилиндрический сосуд, внутри которого находится другой цилиндр – реакционная камера, куда подают газообразный аммиак и 50% азотную кислоту. Внутренний цилиндр служит зоной нейтрализации (химической реакции образования NH4NO3), а кольцевое пространство между внешним и внутренним цилиндром – испарительной зоной.
1) Образовавшийся в зоне нейтрализации слабокислый раствор нитрата аммония, благодаря выделяющейся теплоте реакции закипает. Вода из него испаряется вследствие теплообмена между нейтрализационной и испарительной зонами через стенку внутреннего цилиндра.
2) Из нейтрализатора раствор, содержащий 92-93% NH4NO3, направляется в донейтрализатор, куда подаётся газообразный аммиак, с целью дополнительной нейтрализации слабокислого раствора.
3) Донейтрализованный раствор выпаривают в выпарном аппарате, обогреваемом паром под давлением, до содержания NH4NO3 – 99,8% (плав).
4) Гранулируют плав в грануляционной башне высотой до 55 м. Горячий плав поступает в её верхнюю часть и подаётся в разбрызгиватель.
Снизу навстречу каплям подаётся мощный поток холодного воздуха, за счёт которого происходит охлаждение и кристаллизация капель.
Образовавшиеся гранулы нитрата аммония из нижней части башни поступают на транспортёр и подаются в холодильник кипящего слоя для дополнительного охлаждения и сушки.
Производство карбамида или мочевины
Карбамид или мочевина CO(NH2)2 – ценное удобрение, содержащее 46% азота. Карбамид широко применяют в сельском хозяйстве как индивидуальное удобрение и как азотистую добавку к корму скота.
Химическая и принципиальная схемы производства мочевины.
Карбамид получают путём непосредственного синтеза из аммиака и оксида углерода (IV). Процесс протекает в две стадии:
1-я стадия - реакция образования карбамата аммония:
2NH3 + CO2 = NH4O- CO- NH2;
2-я стадия - дегидратация карбамата аммония с образованием карбамида:
NH4O- CO- NH2 = CO(NH2)2 + H2O
Суммарная скорость синтеза карбамида лимитируется медленной химической реакцией дегидратации – отщепления воды от карбомата аммония.
Было установлено, что скорость лимитирующей стадии растёт при увеличении температуры до 180-200ºС. Однако, при этих температурах карбамат диссоциирует на аммиак и оксид углерода (IV), поэтому процесс необходимо проводить под давлением.
Технологическая схема производства карбамида (мочевины).
Промышленный синтез карбамида проводят без катализаторов, под давлением 18-20 МПа, в интервале температур 180-200ºС.
Для увеличения выхода продукта применяют двойное количество аммиака по сравнению с теоретическим. Выход мочевины достигает 60-70%.
Реакцию проводят в колонне синтеза высотой 24 м и диаметром 1,5 м (Рис. 6.7).
Колонна синтеза представляет собой толстостенный корпус из легированной стали, внутри которой находятся два защитных цилиндра: наружный и внутренний. Цилиндры предохраняют корпус колоны от карродирующего действия реакционной среды и от перегрева.
1) В колонну часть жидкого аммиака подают снизу, он поступает вверх в кольцевое пространство между корпусом колонны и наружным цилиндром, а затем вниз между обоими цилиндрами, защищая тем самым корпус от реакционной смеси. Затем жидкий аммиак поступает во внутренний цилиндр – реакционную зону синтеза.
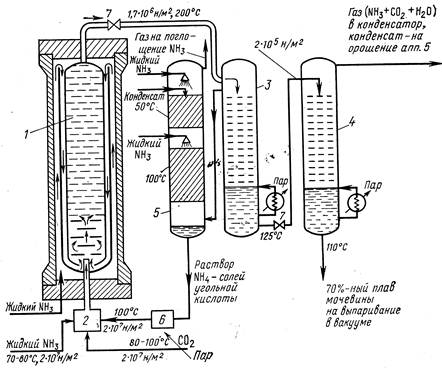
Рис. 6.7. Упрощённая схема синтеза мочевины с полным жидкостным рециклом NH3 CO2: 1 - колонна синтеза; 2 - смеситель; 3, 4 - ректификационные колонны; 5 - промывная колонна; 6 - насос.
2) Кроме этого в реакционную зону синтеза из смесителя под давлением 18-20 МПа и температуре 180-200ºС поступает смесь, состоящая из жидкого аммиака и оксида углерода (IV).
3) Сюда же подаётся циркуляционный раствор аммонийных солей: карбоната аммония (NH4)2CO3 и гидрокарбоната аммония NH4НCO3 из промывной колонны.
Процесс образования карбамата и мочевины протекает (за 30-40 минут) непрерывно и автотермично.
4) Реакционная масса поднимается снизу вверх, и из верхней части колонны отводится плав, содержащий карбамид, неразложившийся карбомат аммония и избыточный аммиак.
Для выделения мочевины плав пропускают последовательно через две ректификационные колоны.
5) В первой колоне с насадкой из колец вследствие снижения давления отгоняется избыточный аммиак и разлагается часть карбамата до карбамида, во второй колонне разложение заканчивается.
6) Парогазовая смесь из ректификационных колон, содержащую NH3, CO2 и пары воды подают в промывную колонну, орошаемую водой и жидким аммиаком.
7) В промывной колонне образуется водный раствор углеаммонийных солей. Концентрированный раствор углеаммонийных солей из промывной колонны возвращают в колонну синтеза.
8) Выходящий из колонны водный раствор мочевины выпаривают в вакууме.
9) Полученный плав карбамида, содержащий 98-99% (NH2)2CO, гранулируют в грануляционной башне путём разбрызгивания.
 2014-02-24
2014-02-24 5209
5209