Схема кислотной переработки фосфатного сырья
Важнейшее значение для питания растений имеют азот, фосфор и калий, от которых зависят обмен веществ в растении и его рост. Азот входит в состав белков и хлорофилла, принимает участие в фотосинтезе. Соединения фосфора играют важную роль в дыхании и размножении растений, участвуя в процессах превращения углеводов и азотсодержащих веществ. Калий регулирует жизненные процессы, происходящие в растении, улучшает водный режим, способствует обмену веществ и образованию углеводов в тканях растений.
Калийные удобрения.
Азотные удобрения. Производство нитрата аммония, карбамида.
Лекция 6
Производство минеральных удобрений.
1) Фосфорные удобрения. Сырьё. Разложение трикальцийфосфата.
Производство простого суперфосфата, фосфорной кислоты,
двойного суперфосфата.
Минеральными удобрениями называются соли и другие неорганические природные или полученные промышленным путем вещества, содержащие в своем составе элементы, содержащие элементы, необходимые для питания растений и вносимые в почву с целью получения устойчивых урожаев сельскохозяйственных культур.
Минеральные удобрения являются наиболее крупнотоннажным видом химической продукции, так как их потребление сельским хозяйством ежегодно составляет сотни миллионов тон.
В образовании тканей растения, в его росте и развитии принимают участие около семидесяти элементов, которые по их роли могут быть разделены на следующие группы:
– элементы органогены (углерод, водород, кислород, азот);
– зольные элементы (фосфор, калий, кальций, магний, сера);
– микроэлементы (бор, молибден, медь, цинк, кобальт);
– элементы, входящие в состав хлорофилла и различных ферментов (железо, марганец).
Из этих элементов углерод, водород и кислород образуют около 90% массы сухого вещества растения, 8—9% составляют азот, фосфор, сера, магний, кальций и калий. На долю остальных элементов, в том числе таких жизненно важных как бор, железо, медь, марганец и другие приходится не более 1—2%.
Основную массу кислорода, углерода и водорода растение получает из воздуха и воды, остальные элементы извлекает из почвы. При современных масштабах культурного земледелия естественный кругооборот питательных элементов в природе нарушается, так как часть их выносится с урожаем и не возвращается в почву (табл. 16.1), а также вымывается из почвы дождевыми водами или переходит в недеятельную форму (иммобилизуется). Например, азот под воздействием микроорганизмов восстанавливается из иона NO3- до N2 и N2O. При этом, чем выше урожайность, тем больше вынос питательных элементов из почвы.
Это вызывает необходимость в компенсации потерь питательных элементов в почве путем внесения в нее веществ, содержащих эти элементы, то есть минеральных удобрений, что позволяет обеспечить высокие урожаи сельскохозяйственных культур. Так, при внесении в почву полного, то есть содержащего азот, фосфор и калий, удобрения, урожай повышается в 1,5—3 раза, в зависимости от вида культуры (табл. 6.1).
Таблица 6.1. Влияние минеральных удобрений на урожайность

Ассортимент выпускаемых промышленностью МУ весьма многообразен.
Классификация минеральный удобрений:
– по природе питательного элемента,
– по содержанию и числу питательных элементов,
– по способам получения и свойствам.
По природе питательных элементов МУ подразделяются на азотные, фосфорные (фосфатные), калиевые (калийные), магниевые (магнезиальные), борные и т.д. Основное место по масштабам производства занимают первые три вида минеральных удобрений.
По числу питательных элементов МУ делятся на простые (однокомпонентные), содержащие только один питательный элемент, и комплексные, содержащие два (двойные типа NP, РК, NK) или три (тройные типа NPK или полные) элемента.
Комплексные МУ подразделяются на сложные, полученные в результате химической реакции, смешанные, представляющие механические смеси, образованные механическим смешением различных простых минеральных удобрений, и сложно-смешанные, представляющие комбинацию первых двух типов.
По содержанию питательного элемента среди МУ выделяют концентрированные (более 33% элемента) и высококонцентрированные (более 60% элемента) удобрения.
По свойствам минеральные удобрения делятся на твердые, жидкие, порошкообразные, кристаллические, гранулированные, растворимые и нерастворимые.
Усвоение МУ растениями зависит от их растворимости и характера почв, главным образом от рН почвы. Азотные и комплексные минеральные удобрения растворимы в воде.
На рис. 6.1 приведена классификация минеральных удобрений.
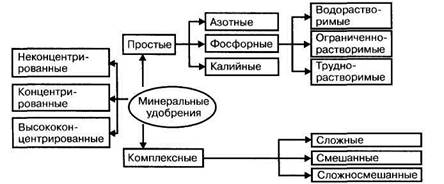
Рис. 6.1. Классификация МУ по природе питательного элемента, их числу и содержанию
1) Фосфорные удобрения. Сырьё. Разложение трикальцийфосфата. Производство простого суперфосфата, фосфорной кислоты, двойного суперфосфата.
Большинство фосфорных и комплексных минеральных удобрений представляют собой разнообразные соли ортофосфорной кислоты. Технологические процессы их производства генетически связаны с процессами производства фосфорной кислоты, оксида фосфора (V) и элементарного фосфора. Они опираются • на одно и то же природное фосфатное сырье и имеют близкую технологическую и аппаратурную базы. На рис. 6.2 представлена взаимосвязь этих производств.
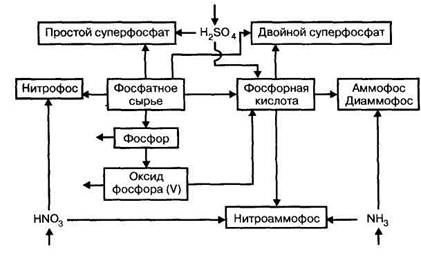
Рис. 6.2. Взаимосвязь производств фосфорных и важнейших комплексных удобрений на основе фосфора
Простые фосфорные удобрения, это кальциевые соли фосфорной (ортофосфорной) кислоты различного состава. В отличие от калийных и азотных удобрений фосфорные удобрения обладают различной растворимостью, которая зависит от природы соли. По растворимости фосфорные удобрения подразделяются на: водорастворимые (группа I); растворимые в органических кислотах или усвояемые (группа II); нерастворимые или растворимые только в сильных минеральных кислотах (группа III).
Фосфорные минеральные удобрения по растворимости делятся водо-растворимые (рН = 7), цитратно- или лимоннорастворимые, то есть растворимые в слабых органических кислотах (рН < 7) и труднорастворимые, то есть растворимые только в сильных минеральных кислотах (рН«7).
Сырьё. Сырьём для производства фосфорных удобрений и фосфорной кислоты служат природные фосфатные руды: апатиты и фосфориты.
Апатиты, имеют состав, отвечающий общей формуле 3Ca3(PO4)2·CaR2 (трикальцийфосфат), где R – это F, Cl или OH. Чаще всего встречаются 3Ca3(PO4)2·CaF2 фторапатиты.
Фосфориты содержат фосфор в виде фторапатита и большое количество примесей – кальцита CaCO3, доломита CaCO3·MgCO3, а также оксидов железа и алюминия.
Основная задача технологии фосфорных удобрений – переработка нерастворимых, трудно усваиваемых растениями солей фосфора в растворимые или усвояемые соли.
Растворимость солей фосфора увеличивается с повышением их кислотности:
средняя соль Ca3(PO4)2 – растворима только в минеральных кислотах;
гидрофосфат кальция CaHPO4 – в слабых почвенных кислотах;
дигидрофосфат кальция Ca(H2PO4)2 –в воде.
Химическая переработка природных фосфатов может быть осуществлена тремя методами: химическим разложением, восстановлением углеродом и термической обработкой. Наиболее распространенный метод переработки фосфатного сырья — его разложение серной, фосфорной или азотной кислотами, используемое в промышленных масштабах для производства фосфорных удобрений, фосфорной кислоты, фосфора и комплексных удобрений на основе соединений фосфора.
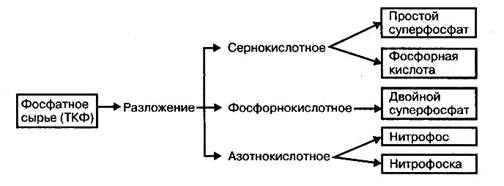
Нерастворимые соли фосфора превращаются в растворимые соли разложением природных фосфатовкислотами.
Простой суперфосфат - самое распространённое фосфорное удобрение. Он представляет собой порошок серого цвета, содержащий дигидрофосфат кальция Ca(H2PO4)2·H2O, полугидрат сульфата кальция CaSO4·0,5H2O и свободную фосфорную кислоту.
Простой суперфосфат получают разложением фторапатита серной кислотой.
Химическая и принципиальная схема получения суперфосфата.
Производство суперфосфата включает две стадии:
1-я стадия - взаимодействие серной кислоты с частицами фторапатита. После смешения двух видов сырья в результате диффузии серной кислоты к частицам фторапатита, на поверхности твёрдых частиц протекает быстрая химическая реакция (30 мин.) с образованием фосфорной кислоты и сульфата кальция:
Ca3(PO4)2 + 3H2SO4 = 2H3PO4 + 3CaSO4 + Q
2-я стадия - образование дигидрофосфата кальция в результате взаимодействия фосфорной кислоты с остатком фосфата кальция:
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2 + Q
Образование дигидрофосфата кальция и его кристаллизация протекает медленно и продолжается от 6 до 30 суток.
Дигидрофосфат кальция при кристаллизации присоединяет воду и превращается в моногидрат дигидрофосфата кальция Ca(H2PO4)2·H2O.
Технологическая схема производства суперфосфата.
Для получения суперфосфата по непрерывному способу используют непрерывно действующий реактор – суперфосфатную камеру.
1. Природный фосфат из бункера и серная кислота дозировано подаются в смеситель с мешалками. Для этого процесса применяют 67-70%-ную серную кислоту, которую нагревают до 70ºС.
2. Под действием серной кислоты природный фосфат частично подвергается быстрому поверхностному разложению с образованием фосфорной кислоты и сульфата кальция.
3. Малорастворимый сульфат кальция кристаллизуется и выпадает в осадок. Это приводит к образованию загустевшей массы – пульпы, которая представляет собой смесь из не прореагировавшего фосфата, фосфорной кислоты и сульфата кальция.
4. Полученная пульпа из смесителя стекает в камеру вызревания. В камере вызревания в течение 30-60 минут завершается быстрый первый этап – схватывание и затвердевание суперфосфатной массы в результате быстрой кристаллизации малорастворимого сульфата кальция. В камере вызревания образовавшаяся фосфорная кислота реагирует с остатками природного фосфата с образованием дигидрофосфата кальция. Температура в камере вызревания поднимается до 110ºС за счёт выделения теплоты реакции. Повышение температуры вызывает испарение воды, поступившей в систему с серной кислотой. В этих условиях наступает перенасыщение раствора, и дигидрофосфат кальция постепенно выкристаллизовывается из раствора. Дигидрофосфат кальция при кристаллизации присоединяет воду и превращается в моногидрат Ca(H2PO4)2·H2O
5. Образование дигидрофосфата кальция и его кристаллизация протекает медленно и продолжается на складе при дозревании суперфосфата в течение 20 суток.
Устройство суперфосфатной камеры.
Камера вызревания или суперфосфатная камера – это вертикальный железобетонный цилиндр, стенки которого выложены кислотоупорными плитками из диабаза (Рис. 6.3).
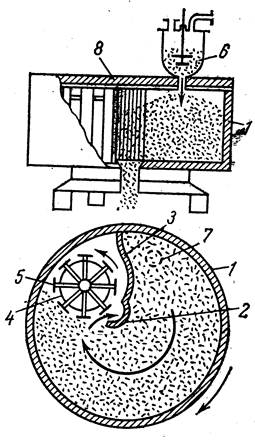
Рис. 6.3 Суперфосфатная камера непрерывного действия (вертикальный и горизонтальный разрезы): 1 - корпус камеры; 2 - полуцилиндр; 3 - неподвижный щит; 4 - карусель-фрезер; 5 - ножи; 6 - смеситель; 7 - место поступления пульпы; 8 - неподвижная крышка.
Этот цилиндр вместе с железобетонным днищем медленно вращается вокруг неподвижной чугунной трубы, предназначенной для выгрузки затвердевшей суперфосфатной массы.
Железобетонная крышка камеры неподвижно закреплена на опорах.
К ней подвешена вертикальная перегородка, отделяющая зону загрузки от зоны выгрузки. Фосфатную пульпу постоянно подают в зону загрузки из смесителя, закреплённого на крышке камеры.
В зоне выгрузки находится фрезер, имеющий крылья с ножами. Фрезер вращается в направлении, противоположном вращению камеры, которая совершает оборот за 1,5-2 часа. Готовый к выгрузке суперфосфат срезается ножами фрезера и проваливается в полую центральную трубу на транспортёр, передающий суперфосфатную массу на склад.
Простой суперфосфат содержит до 20% P2O5, (причём 5% P2O5 в виде свободной фосфорной кислоты), 20% влаги и до 50% CaSO4 в виде балласта.
Наличие в нём влаги и фосфорной кислоты затрудняет хранение и применение. Поэтому целесообразно осуществлять нейтрализацию фосфорной кислоты добавлением молотого известняка или мела и проводить гранулирование.
Гранулирование суперфосфата, улучшающее его физические и агрохимические свойства, производят в наклонных вращающихся барабанах – грануляторах, куда непрерывно подают суперфосфат и вбрызгивают воду (Рис. 6.4):
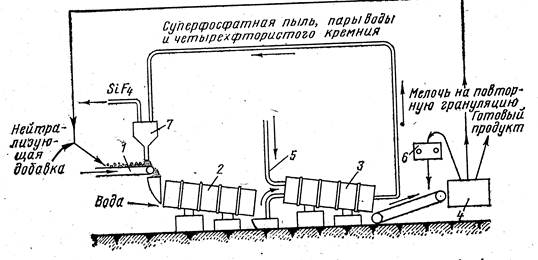
Рис. 6.4. Схема установки нейтрализации и гранулирования суперфосфата: 1 - ленточный транспортёр, подающий суперфосфат; 2 - гранулятор; 3 - барабанная сушилка; 4 - грохот; 5 - подвод горячего воздуха; 6 - валковая дробилка; 7 - циклон.
Увлажнённый порошкообразный суперфосфат закатывают в гранулы. Наличие в суперфосфате большого количества сульфата кальция в виде балласта и сравнительно небольшого количества P2O5 делают его неэкономичным удобрением при дальних перевозках.
Более эффективными являются концентрированные фосфорные удобрения, содержащие до 50% P2O5. Для их производства необходима фосфорная кислота.
Фосфорную кислот у получают экстракционным способом: разложением природных фосфатовсерной кислотой.
В технологии под фосфорной кислотой подразумевают ортофосфорную кислоту H3PO4 (P2O5·H2O) с содержанием в ней 72,4% P2O5.
Экстракционный метод производства фосфорной кислоты основан на реакции разложения природных фосфатовсерной кислотой.
Сернокислотное разложение фосфата кальция представляет собой гетерогенный, необратимый процесс, протекающий в системе «твёрдое тело – жидкость» и описываемый уравнением:
Ca3(PO4)2 + 3H2SO4 = 2H3PO4 + 3CaSO4 + Q
В зависимости от концентрации фосфорной кислоты в системе и температуры протекания реакции образующийся сульфат кальция может при кристаллизации связывать разное количество воды. В связи с этим различают несколько вариантов экстракционного метода получения фосфорной кислоты.
Мы с вами рассмотрим полугидратный метод, в результате которого образуется полуводный кристаллогидрат сульфата кальция CaSO4·0,5H2O.
Процесс производства фосфорной кислоты данным методом является непрерывным (Рис. 6.5):
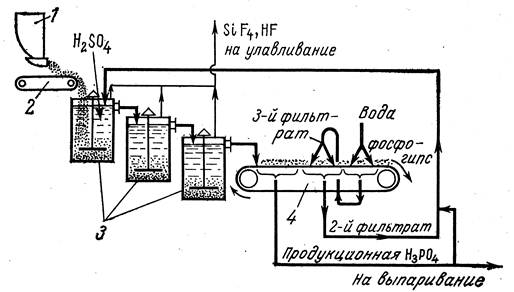
Рис. 6.5 Схема производства фосфорной кислоты экстракционным способом: 1 - бункер; 2 - ленточный весовой дозатор; 3 - экстракторы; 4 - ленточный вакуум-фильтр.
Если реакция разложения природного фосфата требует значительных временных затрат, то используют батарею из нескольких реакционных аппаратов, которые называются экстракторами.
Экстракторы это стальные чаны ёмкостью до 120 м3, выложенные кислотоупорными плитками и снабжённые мешалками.
Экстракторы расположены один выше другого и образуют каскад. Смесь серной кислоты и природный фосфат из бункера подаются в экстрактор. В течение 4 часов при 90ºС пульпа протекает последовательно через несколько экстракторов.
По мере прохождения пульпы через экстракторы образуется фосфорная кислота и завершается процесс кристаллизации сульфата кальция.
Из последнего экстрактора пульпа поступает на трёхсекционный вакуум-фильтр.
Ленточный фильтр представляет бесконечную перфорированную ленту, на которую натянуто фильтрующее полотно. Лента через отверстия общается с тремя вакуум-камерами, в которые собирается основной фильтрат – продукционная фосфорная кислота. Выход фосфорной кислоты достигает 95%.
 2014-02-24
2014-02-24 4953
4953
