РЕАЛЬНЫЕ ГАЗЫ
ОСОБЕННОСТИ СТРОЕНИЯ ГАЗОВ, ЖИДКОСТЕЙ И ТВЕРДЫХ ТЕЛ
Р.Н.Грабовский. Курс физики. 1980 г., стр.168-174.
1. Реальные газы. Взаимодействие между молекулами газа. Уравнение Ван–дер–Ваальса. Сравнение опытных и теоретических изотерм реального газа. Критическое состояние вещества.
Уравнения молекулярно-кинетической теории довольно хорошо описывают поведение реальных газов при достаточно высокой температуре и низком давлении. Это и понятно, ведь такое состояние реального газа наиболее близко к модели идеального газа, на основе которой получены все выводы МКТ. Однако с ростом давления и понижением температуры среднее расстояние между молекулами уменьшается и силы молекулярного взаимодействия растут. Например, при н.у. объем молекул составляет 1/10000 от занятого газом объема, а при давлении 500 атм (500 МПа) он будет составлять уже половину всего объема газа. Совершенно очевидно, что при этих условиях законы МКТ перестает работать, например, PV ¹ const при Т = const.
Таким образом, задача заключается в том, чтобы получить такое уравнение состояния реального газа, которое бы учитывало объем молекул и их взаимодействие.
Из всех уравнений состояния реального газа, предложенных в свое время, самым простым и достаточно точным оказалось уравнение голландского физика Ван-дер-Ваальса:
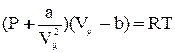
Как видно, оно получено из уравнения Клапейрона для моля идеального газа путем введения поправок. Константы а и b имеют различные значения для разных газов и определяются опытным путем. В СИ 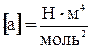 ,
, 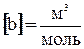 .
.
Поправка «b» определяет ту часть объема, занимаемого газом, которая недоступна для движения из-за конечных размеров самих молекул. b = 4 Vмолекул. УТОЧНИТЬ!
Поправка 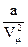 определяет внутренне давление р´, обусловленное взаимным притяжением молекул друг к другу. Очевидно, если бы вдруг это притяжение исчезло, то для того, чтобы удержать газ в пределах того же объема, пришлось бы увеличить внешнее давление на
определяет внутренне давление р´, обусловленное взаимным притяжением молекул друг к другу. Очевидно, если бы вдруг это притяжение исчезло, то для того, чтобы удержать газ в пределах того же объема, пришлось бы увеличить внешнее давление на
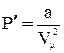 .
.
Для произвольного количества газа 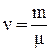 уравнение Ван-дер-Ваальса имеет вид:
уравнение Ван-дер-Ваальса имеет вид: 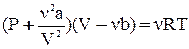 .
.
 2014-02-09
2014-02-09 407
407






