Обратимые и необратимые процессы.
Определение 1.
Процесс называется обратимым, если изменение его направления (в общем смысле этого слова, например, во времени!) на обратное, то система вернётся в исходное состояние. В противном случае процесс называется необратимым.
Качественной особенностью систем из большого числа частиц по сравнению с чисто механическими системами является необратимый характер термодинамических процессов.
Обратимость механического процесса означает, что если изменить направление процесса на обратное, то тело (макрочастица, но одна!), обладающее определенными значениями координат и скорости в конечном состоянии, будет проходить последовательность тех же состояний, которую оно проходило при первоначальном направлении процесса, но в обратном порядке. То есть, обратимость механического процесса обусловлена его детерминированностью, что устанавливается вторым законом Ньютона.
Всякий термодинамический процесс всегда необратим. Он включает в себя множество независимых случайных событий (например, столкновения частиц!). И для того, чтобы он мог происходить в обратном направлении, необходимо, чтобы реализовалась вся эта случайная последовательность событий в обратном порядке. Иными словами, необратимость термодинамических процессов обусловлена их вероятностным характером.
Вследствие необратимости термодинамических процессов все процессы в изолированной системе протекают лишь в одном направлении — в направлении приближения системы к состоянию теплового равновесия. Будучи выведеной из состояния равновесия, система переходит в новое состояние равновесия спустя некоторое время — время релаксации. Причём переход системы к равновесному состоянию представляет собой необратимый процесс, поскольку вероятность самопроизвольного перехода равновесной системы в неравновесное состояние ничтожно мала.
Рассмотрим некоторые механизмы неравновесной релаксации системы к состоянию равновесия.
Определение 1.
Длина свободного пробега l – это средняя длина пути молекулы в газе между столкновениями.
Определение 2.
Среднее время свободного пробега – это время, равное t = l/v, где v — средняя скорость теплового движения молекул.
Сущность процесса релаксации состоит в том, что при выведении системы из состояния равновесия в газе возникает поток соответствующей величины, например, тепла, массы, концентрации частиц и др. При приближении системы к равновесию этот поток исчезает, перераспределяясь по всей системе.
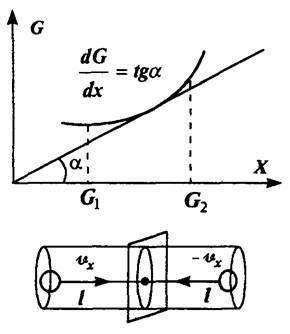 Определим поток произвольной физической величины как изменение этой величины в единицу времени в какой-либо точке пространства:
Определим поток произвольной физической величины как изменение этой величины в единицу времени в какой-либо точке пространства:
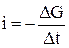 , (1)
, (1)
где ΔG — разность значений величины Gв соседние моменты времени.
Знак минус означает, что направление потока противоположно направлению возрастания величины.
В выражение для потока введём пространственную координату – 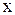 :
:
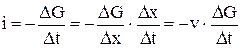 . (2)
. (2)
Если речь идёт о потоке частиц, это выражение нужно умножить на их число — число носителей величины G, которые в состоянии пересечь в единицу времени единичную площадку, перпендикулярную оси ОX.
Число таких частиц равно числу частиц, движущихся параллельно оси ОXи отстоящих от указанной площадки на расстояние, не большее длины свободного пробега l, т. е. заключенных в объеме, основание которого есть единица, а длина равна 2l.
Число частиц в единице объема, движущихся в направлении оси ОХ, равно n/6 и (ввиду равновероятности движения в любом из возможных шести направлений: вверх-вниз, вправо-влево, вперёд-назад!).
Полный поток величины Gбудет равен:
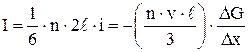 , (3)
, (3)
где величина (n·v·l/3) называется коэффициентом переноса.
При 
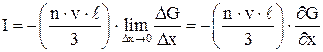 , (4)
, (4)
где частная производная – 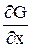 есть скорость изменения физической величины в направлении оси ОХ.
есть скорость изменения физической величины в направлении оси ОХ.
 2014-02-09
2014-02-09 463
463






