б) Нейтрализация СВ добавлением реагентов.
Если на предприятиях имеются только кислые или только щелочные СВ и если невозможно обеспечить их взаимную нейтрализацию, применяют реагентный метод нейтрализации. Чаще всего нейтрализуют кислые СВ.
Выбор реагента для нейтрализации СВ зависит от вида кислот и их концентрации, а также от растворимости солей, образующихся в результате химической реакции. Для нейтрализации минеральных кислот применяют любой щелочной реагент, но чаще всего известь в виде пушинки или известкового молока и карбоната кальция или магния в виде суспензии. Эти реагенты сравнительно дешевы и общедоступны, но имеют ряд недостатков: обязательно устройство усреднителей перед нейтрализационной установкой, затруднительно регулирование дозы реагента по рН нейтрализованной воды. Скорость реакции между раствором кислоты и твердыми частицами суспензии относительно невелика, и зависит от размеров частиц и растворимости образующегося в результате реакции соединения. Поэтому окончательная активная реакция в жидкой фазе устанавливается не сразу, а по истечении некоторого времени (10 – 15 мин). Это относится к СВ, содержащим сильные кислоты (серная), кальциевые соли которых труднорастворимы в воде.
При нейтрализации производственных СВ, содержащих серную кислоту, реакция в зависимости от применяемого реагенте протекает по уравнениям:
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
H2SO4 + CaCO3 = CaSO4 + H2O + CO2
Образующийся гипс кристаллизуется из разбавленных растворов в виде CaSO4 * 2H2O. Растворимость этой соли при температуре 0 – 400С колеблется от 1,76 до 2,11 г/л.
При более высокой концентрации сульфат кальция выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли которых труднорастворимы в виде, необходимо устраивать отстойники шламонакопители. Существенным недостатком метода нейтрализации серной кислоты известью является также образование пересыщенного раствора гипса, выделение которого из СВ может продолжаться несколько суток, что приводит к зарастанию трубопроводов и аппаратуры. Присутствие в СВ высокомолекулярных органических соединений усиливает устойчивость пересыщенных растворов гипса, поскольку эти соединения сорбируются на гранях кристаллов CaSO4 и препятствуют их дальнейшему росту.
Для уменьшения коэффициент пересыщения используется метод рециркуляции образующиеся в результате нейтрализации осадка сульфата кальция. Концентрация ионов Са в СВ уменьшается при увеличении дозы рециркулирующего осадка: продолжительность перемешивания этой воды должна быть больше 20-30 минут. Для уменьшения зарастания трубопроводов, по которым транспортируются нейтрализованные известью сернокислотные остатки, применяют методы промывки, увеличивают трубопроводы на пластмассовые.
Для нейтрализации органических жирных кислот применяют известь, содержащую больше 25-30% активного СаО, или смесь извести с 25% - ной технической аммиачной водой.
Доза реагента для отработки СВ определяют из условий полной нейтрализации содержащихся в них кислот или щелочей и принимается на 10% больше расчетной, имеющихся в справочной литературе или инструкции. Если в щелочных и кислых ПСВ присутствуют ионы металлов, то дозу реагента следует определять с учетом выделения в осадок солей тяжелых металлов.
Количество реагентов для нейтрализации СВ определяется по формуле:
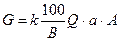
где к – коэффициент запаса расхода реагента по сравнению с теоретическим (для известкового молока 4,5 для известкового теста и сухой извести 1,5)
В – количество активной части в товарном продукте, %
Q- количество СВ, подлежащих нейтрализации, м3
a – расход реагента для нейтрализации кг/кг
А – концентрации кислот или щелочей, кг/м3
Процессы реагентной нейтрализации ПСВ осуществляются на нейтрализационных установках или станциях, Рис.
Песколовки предусмотрены для задержания минеральных частиц размером больше 0,2 – 0,25 мм. Они бывают горизонтальные с круговым движением СВ, с прямолинейным движением СВ, тангенциальные.
Они предусматриваются при наличии в СВ тяжелых механических примесей. Резервуары усреднители для кислых и щелочных СВ выполняются из материалов с антикоррозийной защитой. Усреднители предназначаются для регулирования состава и поступления СВ на очистные сооружения, позволяют выравнивать пиковые расходы и концентрации СВ, т.е. они представляют собой системы с резервуары СВ перемешивание поступающей сточной воды с тем, чтобы конечные концентрации загрязняющих веществ или рН были приблизительно одинаковыми все время.
Поступающие в резервуары СВ перемешиваются воздухом. При наличии одновременно кислых и щелочных СВ учитывается их взаимная нейтрализация. Для нейтрализации гашенная известь применяется в основном в виде известкового молока 5%-ной концентрации по активному оксиду кальция. Для превращения комовой извести – кипелки в форму, удобную для дозирования, ее следует погасить:
CaO + H2O = Ca(OH)2 + 67 кДж
Схема 1. Принципиальная схема станции реагентной нейтрализации.
 |  |  |  | ||||||||||
 |  | ||||||||||||
 |  | ||||||||||||
 |  |  | |||||||||||
 |  | ||||||||||||
 | |||||||||||||
 |  |  |  | ||||||||||
 |  | ||||||||||||


 |  | ||||||
 | |||||||
 | |||||||
 | |||||||
 |
 | ||||||||
 | ||||||||
 | ||||||||
 |
I, II - подача соответственно кислых и щелочных сточных вод
III, IV- выпуск соответственно нейтрализованных сточных вод и осадка
1 – песколовка, 2 – усреднители, 3 – склад реагентов, 4 – растворные баки, 5 – дозатор, 6 – смеситель, 7 – нейтрализатор, 8 – отстойник, 9 – осадкоуплотнитель, 10 – вакуум – фильтр, 11 – накопитель обезвоженных осадков, 12 – шалашовые площадки.
Для этого применяют специальные известегасительные аппараты – термомеханические и барабанные. Известковые молоко из аппаратов гашения извести сливают в банки с пропеллерными или лопастными мешалками с вертикальной осью вращения, с частотой 40 мин-1.
Рабочий раствор подается в нейтрализационную сточную воду с помощью насосов или дозаторов. Реагенты можно дозировать в виде порошка, суспензии, растворов и газа.
Дозаторы сухих реагентов направляют их в открытый поток или в смеситель, где сухой реагент быстро растворяется. От суспензии растворы или газы подаются в открытый поток или напорные трубопроводы.
Для перемешивания реагента со сточной водой применяют гидравлические и механические системы. В гидравлических системах смесителях смешение реагентов с водой за счет энергии потока воды, расходуемой на повышении его турбулентности. В механических системах турбулентность потока усиливается мешалками различных типов.
Из смесителей СВ поступают в камеры реакции. Они бывают периодического и непрерывного действия. Продолжительность пребывания кислых или щелочных СВ и реагента в камерах реакции принимается равной 5 мин, а при нейтрализации кислых СВ содержащих ионы тяжелых металлов – 30 мин. Для ускорения хода реакции нейтрализации и осаждения тяжелых металлов в камерах реакции производится непрерывное перемешивание мешалками. Для отстаивания получающихся осадков применяют горизонтальные, радикальные или вертикальные отстойники, рассчитанные на пребывание в них СВ не менее 2 ч. при доведении рН до 7,5 – 8,5. иногда вместо отстойников возможно применение флотаторов, из которых выделенный осадок удаляется сверху.
После отстойников (флотаторов) осадок направляется для обезвоживания на шламовые площадки с дренажем.
Если станция нейтрализации не имеет отстойников, то нейтрализованная сточная вода направляется непосредственно из камер реакции в накопители, предназначенные для осветления воды и складирования осадка.
Если осадок, выделенный из нейтрализованной сточной воды в отстойниках, в дальнейшем подлежит механическому обезвоживанию на вакуум – фильтрах, или на центрифугах, то его из отстойников перекачивают в осадкоуплотнители, рассчитываемые на продолжительность пребывания в них не менее 6 часов.
2 Окисление:
а) окисление активным хлором
Окислительный метод очистки применяют для обезвреживания ПСВ, содержащих токсичные примеси (цианиды), или соединение, которые нецелесообразно извлекать из сточных вод, а также очищать другими методами (сероводород, сульфиды). Такие виды сточных вод встречаются в машиностроительной, горнодобывающей, нефтехимической, ц/б промышленности. Б/т промышленности таких СВ практически нет и поэтому мы познакомимся лишь с основными принципами.
Как вам известно окисление в узком смысле реакция соединения какого – либо вещества с кислородом, сущность которой состоит в отнятии электронов от атомов и ионов.
В практике обезвреживания ПСВ в качестве окислителей используют хлор, гипохлорит кальция и натрия, хлорную известь, диоксид хлора, озон, технический кислород и кислород воздуха. Иногда пероксид водорода, перманганат и бихромат калия.
При введение в воду хлор гидролизуется, образуя хлорноватистую кислоту и соляную кислоту:
СI + H2O – HOCI + HCI
В сильнокислой среде равновесие этой реакции сдвинуто влево, и в воде присутствует молекулярный хлор: а при рН больше 4 молекулярный хлор практически отсутствует. Образовавшиеся при гидролизе СI2 HOCI диссоциирует на ион гипохлорита и Н+. Соотношение между HOCI и OCI- в воде при различных рН имеет такой графический вид.
Гипохлориты кальция и натрия, а также хлорная известь образуются в воде хлорноватистую кислоту и ион гипохлорита в соотношениях определяемых рН водной среды. кислородное окисление цианидов хлором можно проводить только в щелочной среде (рН больше 9-10).
CN- + 2OH- + CI2 – 2CN- + 2CI- + 2H2O
Образующиеся цианаты можно окислить до элементарных азота и диоксида углерода:
2CNO- + 4OH- + 3CI2 – 2CO2 + 6CI- + N2 + 2H2O
При снижении рН возможно протекание реакции прямого хлорирования цианида с образованием токсичного хлорциана:
CN- + CI2 – 2CNCI- + CI-
Исходя из вышеизложенного наиболее подходящем и целесообразным методом является окисление цианидов гипохлоритами в щелочной среде (рн = 10-11). В качестве реагента, содержащего ион гипохлорита ОCI-, служат хлорная известь, гипохлорита кальция и натрия. Между гипохлоритом и простыми цианидами протекает следующая реакция6
CN- + ОCI – CNО- + CI-
Реакция протекает быстро (1-3 мин) и полно. Образующиеся метиличные цианаты постоянно гидролизуются с образованием ионов аммония и карбонатов:
CNО- + 2H2O – NH4+ + CO32-
На практике при применении этого способа очистки для расчетов пользуются понятием активного хлора, вернее с технометрическим коэффициентом и по активному хлору. Для определения коэффициента и подсчитываются количество активного хлора в гипохлорите. Активный хлор определяется по количеству грамм – атомов йода, выделенных данным реагентом из йодистого калия в кислой среде.
Выделившиеся 2 грамма – атома йода соответствуют 2 грамм – атома активного хлора. Таким образом, соотношение масс реагирующих цианида – иона и активного хлора гипохлорита равно 26:71.
Сильно, на 1 г цианид – иона требуется 2,73 г активного хлора, т.е. n=2,73.
При наличие в СВ аммиака аммонийных солей или органических веществ, содержащих аминогруппы хлора, хлорноватистая кислота и гипохлориты вступают с ними в реакцию, образуя моно- и дихлорамины, а также треххлористый азот:
NH3 + HOCL → NH2CL + H2O
NH2CL + HOCL → NHCL2 + H2O
NHCL + HOCL → NCL3 + H2O
При обезвреживании сточных вод обычно применяют 5%-ный рабочий раствор реагента, по активному хлору.
б) окисление кислородом воздуха, озонирование.
Для окисление сульфидных СВ целлюлозных, нефтеперерабатывающих, и нефтехимических заводов чаще, чем хлорсодержащие реагенты применяют кислород. Реакция окисления идет в жидкой фазе при повышение температуры и давления.
При окисление СВ варочных цехов рН 9 – 9,5 протекают следующие реакции:
2HS- + 2O2 → S2O32- + H2O
2HS- + 2O2 + 2OH- → 2SO32- + 2H2O
2HS- + 4O2 + 2OH- → 2SO42- + 2H2O
то есть в процессе окисления сера изменяет свою валентность с «-2» до «+6».
S2- → SO42-
В процессе окисления рН СВ понижается.
Озон является сильным окислителем и обладает способностью разрушать в водных растворах при нормальной температуре многие органические вещества и примеси. При давление 0,1 МПа и температуре 00 С растворимость озона в воде составляет 0,4 г/л. растворимость озона в воде зависит также от активной реакции среды, наличия кислот, щелочей, солей. Так при наличии кислот и солей растворимость озона в воде увеличивается, а при наличии щелочей уменьшается. Озон самопроизвольно диссоциирует на воздухе и в водных растворах, распадаясь на молекулу и атом кислорода. Скорость распада в водном растворе возрастает с увеличением солесодержания, значения рН и температуры.
По сравнению с другими окислителями, озон имеет ряд преимуществ. Его можно получать непосредственно на очистных установках, причем сырьем служит технических кислород или атмосферный воздух. Применение озонирования не приводит к увеличению солевого состава очищаемых сточных вод, не загрязняет воду продуктами реакции, а сам процесс легко поддается автоматизации.
В процессе обработки сточных вод озон, подаваемый в камеру реакции в виде озоно - воздушной или озоно - кислородной смеси вступает в химические реакции с загрязняющими СВ веществами. То есть озонирование представляет собой абсорбционный процесс, осложненный химическими реагентами.
Озон получают непосредственно на очистных сооружениях путем тихого (короткого) электрического разряда в воздухе. Тихий разряд образуется в узком газовом пространстве между двумя электродами, к которым подведен ток напряжением 5 – 25 тыс. В.
Молекулы кислорода под действием электрических разрядов дробятся, и образовавшиеся атомы легко присоединяются к целым молекулами вследствие их молекулярного сродства, образуя молекулу озона:
О + О2 ↔ О3
Большое занчение имеет также то, что атом кислорода, выделяющейся в этой реакции, может взаимодействовать с молекулой озона с выделением теплоты:
О + О3 ↔ 2О2 + 400 кДж
Очищенная от пыли и осушенная озоно - воздушная смесь направляется в контактную камеру и смешивается с обрабатываемой сточной водой. Озоно – воздушная смесь распыляется трубками из пористой керамики.
Однако, нужно иметь в виду, что озон чрезвычайно токсичен и проникает в органы дыхания и центральную нервную систему. Поэтому нужно уделять большое внимание герметизации реакторов и вентиляции помещений. В связи с коррзионностью озона все элементы установок и трубопроводы должны изготовляться из нержавеющей стали и алюминия.
Исследования по окислению различных органических загрязнений озоном показали эффективность этого способа при обработке водных растворов содержащих фенолы, циклопентан, ПАВ, нефти и др.
В качестве примера рассмотрим окисление сероводорода, при этом на первой стадии наблюдается выделение серы, а на второй окисление непосредственно до H2SO4.
H2S + O3 → S + O2 + H2O
3H2S + 4O3 → 3H2SO4
Реакции протекают одновременно, но при избытке озона преобладает вторая.
При окислении цианидов протекает следующая реакция:
CN- + O3 → CNO- + O2
CNO- + 2H+ + H2O → CO2 + NH4
Процесс озонирования можно интенсифицировать совместным воздействием озона и ультразвука, озона и УФ – излучения.
 2014-02-12
2014-02-12 1119
1119








