Адгезия (прилипание, сцепление, слипание) – поверхностное явление, заключающееся во взаимодействии частиц поверхностных слоев двух конденсированных фаз.
Возможны три случая адгезии: адгезия между двумя жидкостями (ж-ж), между жидкостью и твердым телом (т-ж), между твердыми телами (т-т).
С адгезией сталкиваемся повсеместно: при покрытии различных поверхностей лаком и краской, склеивании материалов и т.д.
Адгезия бывает положительной (полезной) и отрицательной.
Хорошая адгезия лакокрасочных покрытий определяет эксплуатационные и потребительские качества этих покрытий. Эффективность инсектицидных препаратов, применяемых для борьбы с сельскохозяйственными вредителями, во многом определяется адгезией капель или частиц этих препаратов к листьям растений. Здесь адгезия играет положительную роль.
В пищевой промышленности отрицательная адгезия связана с прилипанием пищевых масс (тесто, сгущенное молоко, сметана и т.п.) к стенкам оборудования, что обусловливает производственные потери.
Еще одно отрицательное проявление адгезии – аутогезия (комкование). Например, аутогезия частиц сухого молока, кофе.
Количественно адгезию характеризуют величиной работы адгезии Aадг, т.е. работой, затраченной на отрыв молекул одной фазы от молекул другой фазы.
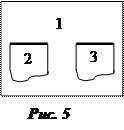 Субстрат (подложка) 2 – поверхность, на которую наносится вещество, наносимое вещество – адгезив 3.
Субстрат (подложка) 2 – поверхность, на которую наносится вещество, наносимое вещество – адгезив 3.
Субстрат и адгезив находятся в воздухе 1 (рис. 5).
Пусть s21 и s31 –поверхностное натяжение субстрата и адгезива на границе с воздухом соответственно.
Gпов = s S,
где S – площадь поверхности.
Рассмотрим единицу площади поверхности субстрата и адгезива. Тогда суммарная поверхностная энергия системы в исходном состоянии
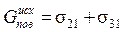 .
.
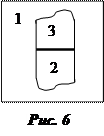
Совместим поверхности субстрата и адгезива (нанесем фазу 3 на фазу 2) (рис. 6). Суммарная поверхностная энергия при этом станет равной
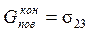 ,
,
где s23 – поверхностное натяжение на границе раздела субстрата и адгезива.
Изменение поверхностной энергии
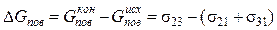 .
.
С точки зрения термодинамики для равновесного обратимого процесса
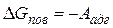 .
.
Тогда
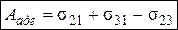 .
.
Это уравнение впервые вывел Дюпре. Из уравнения Дюпре следует, что работа адгезии тем больше, чем больше поверхностные натяжения субстрата и адгезива и чем меньше конечное межфазное натяжение.
Смачивание – частный случай адгезии – взаимодействие жидкости с твердой или более плотной жидкой фазой при наличии одновременного контакта трех несмешивающихся фаз, одна из которых газ (воздух).
Рассмотрим явление смачивания на примере капли жидкости, нанесенной на поверхность твердого тела. При этом возможны следующие случаи.
Полное смачивание. Капля жидкости самопроизвольно растекается на поверхности, пока не покроет всю поверхность или пока слой жидкости не станет мономолекулярным. Пример: капля воды на обезжиренном стекле.
Полное несмачивание. Капля жидкости на твердой поверхности самопроизвольно принимает почти сферическую форму. Пример: капля ртути на неметаллической поверхности.
Между этими крайними случаями наблюдаются различные промежуточные случаи, когда поверхность частично смачивается жидкостью.
Количественной мерой смачивания служит краевой угол смачивания Q – угол между твердой поверхностью и касательной, проведенной к поверхности капли в точке соприкосновения трех фаз. Его измеряют со стороны жидкой фазы (рис. 7).
 Если Q < 90° – жидкость смачивает поверхность, Q > 90° – поверхность смачивается плохо или совсем не смачивается.
Если Q < 90° – жидкость смачивает поверхность, Q > 90° – поверхность смачивается плохо или совсем не смачивается.
Линия пересечения всех трех поверхностей раздела называется линией смачивания. Замкнутая линия смачивания образует периметр смачивания.
Угол смачивания зависит от поверхностного натяжения фаз.
|
|
|
|
|

|



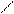


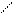

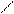

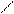
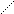
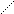


|
|
газ с поверхностным натяжением sт-г и поверхность твердое тело – жидкость с поверхностным натяжением sт-ж (рис. 8).
Равновесие капли определяется одновременным воздействием этих трех поверхностных натяжений, которые на рисунке показаны в виде векторов (направлены по касательной к соответствующей поверхности). Два из них (sт-г и sт-ж) действуют на поверхности твердого тела в противоположных направлениях. Сила sж-г направлена к поверхности под углом Q.
При равновесии справедливо соотношение
sт-г = sт-ж + sж-гcos Q,
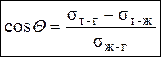 – уравнение Юнга.
– уравнение Юнга.
Из уравнения Юнга следует, что смачивание зависит от поверхностного натяжения соприкасающихся фаз:
1) sт-г > sт-ж, cos Q > 0, Q < 90° – если поверхностная энергия фазы, на которую наносится жидкость больше поверхностной энергии на границе раздела твердое тело – жидкость, поверхность смачивается жидкостью, т.е. высокоэнергетические поверхности лучше смачиваются жидкостью;
2) sт-г < sт-ж, cos Q < 0, Q > 90° – в данном случае поверхность плохо смачивается жидкостью;
3) чем меньше поверхностное натяжение жидкости на границе с воздухом sж-г, тем жидкость лучше смачивает поверхность.
Все жидкости по способности смачивать поверхность можно разделить на 3 группы:
1) вода – полярная жидкость, при t = 20 °С s = 7,2×10-2 Дж/м2 – высокоэнергетические поверхности (с большим sт-г) вода смачивает хорошо, низкоэнергетические – плохо;
2) органические растворители, s = (1,8-3,0)×10-2 Дж/м2 – обладают хорошей смачивающей способностью;
3) ртуть Hg, s = 46×10-2 Дж/м2 – не смачивает поверхность за исключением случаев, когда идет химическое взаимодействие.
Адгезию жидкости и смачивание можно изменять за счет модификации свойств твердых поверхностей путем их гидрофобизации или гидрофилизации и за счет регулирования поверхностного натяжения жидкости.
Вопрос. Как увеличить и уменьшить смачивание поверхности?
 2014-02-12
2014-02-12 10182
10182