Адгезия жидкости и смачивание проявляются многопланово (табл. 3.2). Эти явления определяют такие процессы как пропитку, экстракцию, флотацию, смазку и многие другие. Этот далеко не полный перечень, свидетельствует о практической значимости адгезии жидкости и смачивания.
Рассмотрим более подробно некоторые процессы, перечисленные в табл. 3.2. Остановимся на процессе флотации, непосредственно связанным с адгезией жидкости и смачиванием.
Флотация — это метод обогащения полезных ископаемых, основанный на различной смачиваемости водой ценных минералов и пустой породы. Наибольшее значение имеет пенная флотация. Элементарный акт пенной флотации заключается в смачивании и адгезии частиц к пузырьку.
На гидрофильной поверхности адгезия жидкости максимальна и наблюдается растекание капли (см. рис. 3.3, а). В противоположность этому адгезия газовой (воздушной) среды, обрамленной жидкостью, будет минимальной, и газовая фаза свертывается в пузырек (см. рис. 3.3, в). Применительно к капле воды на гидрофобной поверхности наблюдаются процесс ее свертывания (см. рис. 3.3, б) и минимальная адгезия. Адгезия в отношении газовой среды на гидрофобной поверхности максимальна (см. рис. 3.3, г).
Равновесную работу адгезии частиц к пузырьку на границе раздела твердое тело — газ можно вывести из тех же соображений, которые были рассмотрены в случае адгезии капель жидкости к твердым поверхностям. Величина этой работы
Wa = σЖГ(1—cos θ). (3.20)
Формула (3.20) по структуре напоминает формулу (3.8), но отличается от нее тем, что величина cosθ отрицательна. Это означает, что на гидрофобной поверхности (см. рис. 3.3, г), когда θ > 90° и cosθ < 0, равновесная работа адгезии частиц к пузырьку будет максимальной. На гидрофобной поверхности (см. рис. 3.3, б), наоборот, адгезия капель будет минимальной.
Таким образом, необходимым условием адгезии и закрепления частиц на пузырьках является гидрофобность, т. е. несмачивание поверхности частиц.
В пенной флотации пузырьки газа выполняют несколько функций. Они способствуют лучшему перемешиванию взвешенных частиц, выступают в роли носителей, на поверхности которых закрепляются частицы. Эти частицы вместе с пузырьками всплывают на поверхность и таким образом полезные ископаемые отделяются от пустой породы.
Широкое применение пенной флотации обусловлено возможностью регулирования свойств частиц и разделения минералов, близких по своим поверхностным свойствам. Фактически между твердой поверхностью частицы и газовой фазой пузырька существует прослойка жидкости. Именно эта прослойка жидкости оказывает порой решающее влияние на адгезию частиц к пузырьку.
Т а б л и ц а 3.2
Особенности адгезии жидкости и смачивания в некоторых процессах
| Процессы | Объекты | Примеры | Факторы, определяющие особенности процесса |
| Смачивание | Любые поверхности, контактирующие с любой жидкостью | Лаки, краски, клей, растворы, органические растворители | Свойства и шероховатость поверностей, краевой угол и вязкость жидкости |
| Пропитка | Древесина, ткани, почва, порошки, пористые материалы | Аппретирование, гидрофобизация тканей, растворимый кофе | Пористость материала, поверхностное натяжение, вязкость жидкости |
| Экстракция | Сырье для пищевой и других отраслей промышленности | Извлечение сахара, масла и др. веществ | Структура сырья, вязкость и поверхностное натяжение растворителя |
| Флотация | Минералы, руда | Обогащение минералов | Пенообразование |
| Смазка | Любые трущиеся поверхности | Многочисленные механизмы, агрегаты | Равномерное распре деление смазки и копирование поверхности |
| Очистка поверхностей от загрязнений | различные загрязненные поверхности | Мойка, чистка, стирка и т.д. | Моющее действие (см. параграф 21.4) |
| Капиллярный подъем | Корневая и капиллярная система растений | Питание растений | Поверхностное натяжение воды с учетом растворимых в ней веществ |
Наличие жидкой среды между газом (воздухом) и твердой поверхностью позволяет путем введения в воду специальных веществ и их адсорбции изменять адгезию частиц. Мощным средством регулирования адгезии являются поверхностно-активные вещества — ПАВ (см. гл. 5).
При адсорбции ПАВ в прослойке жидкости, формирующей оболочку пены или находящейся на твердой поверхности, гидрофильный радикал молекул ПАВ ориентирован в сторону водной среды, а гидрофобный — в сторону твердого тела. Это приводит к ухудшению смачивания поверхности частиц и, в соответствии с уравнением (3.20), к росту адгезии частиц к пузырьку.
ЛЕКЦИЯ №8
АДСОРБЦИЯ. ОБЩИЕ ПОНЯТИЯ,
На границе конденсированной (т.е. твердой или жидкой) фазы с газом поверхностное натяжение всегда положительно, поскольку частицы конденсированной фазы взаимодействуют друг с другом сильнее, чем с молекулами газа. Согласно принципу минимума свободной энергии, конденсированная фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию. Это может быть результатом либо уменьшения площади поверхности фазы (именно поэтому капля жидкости в невесомости принимает форму сферы), либо уменьшения поверхностного натяжения при появлении на поверхности раздела фаз новых частиц – молекул газа либо растворенного вещества. Процесс самопроизвольного изменения концентрации какого-либо вещества у поверхности раздела двух фаз называется адсорбцией. Адсорбентом называется вещество, на поверхности которого происходит изменение концентрации другого вещества – адсорбата.
4.1.2 Адсорбция на границе раствор – пар
В жидких растворах поверхностное натяжение σ является функцией от концентрации растворенного вещества. На рис. 4.1 представлены три возможных зависимости поверхностного натяжения от концентрации раствора (т.н. изотермы поверхностного натяжения). Вещества, добавление которых к растворителю уменьшает поверхностное натяжение, называют поверхностно-активными (ПАВ), вещества, добавление которых увеличивает или не изменяет поверхностное натяжение – поверхностно-инактивными (ПИАВ).
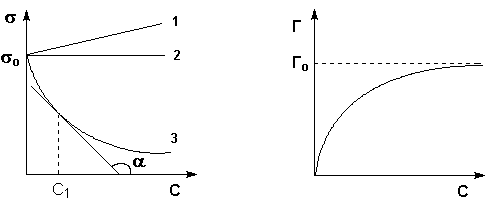
| Рис. 4.1 Изотермы поверхностного натяжения и адсорбции на границе раствор - пар ПАВ (3) и ПИАВ (1) |
Уменьшение поверхностного натяжения и, следовательно, поверхностной энергии происходит в результате адсорбции ПАВ на поверхности раздела жидкость – пар, т.е. того, что концентрация поверхностно-активного вещества в поверхностном слое раствора оказывается больше, чем в глубине раствора.
Количественной мерой адсорбции на границе раствор-пар является поверхностный избыток Г (гамма), равный числу молей растворенного вещества в поверхностном слое. Количественное соотношение между адсорбцией (поверхностным избытком) растворенного вещества и изменением поверхностного натяжения раствора с ростом концентрации раствора определяет изотерма адсорбции Гиббса:
 (IV.5)
(IV.5)
График изотермы адсорбции ПАВ представлен на рис. 4.2. Из уравнения (IV.5) следует, что направление процесса – концентрирование вещества в поверхностном слое или, наоборот, нахождение его в объеме жидкой фазы – определяется знаком производной dσ/dС. Отрицательная величина данной производной соответствует накоплению вещества в поверхностном слое (Г > 0), положительная – меньшей концентрации вещества в поверхностном слое по сравнению с его концентрацией в объеме раствора.
Величину g = –dσ/dС называют также поверхностной активностью растворенного вещества. Поверхностную активность ПАВ при некоторой концентрации С1 определяют графически, проводя касательную к изотерме поверхностного натяжения в точке С = С1; при этом поверхностная активность численно равна тангенсу угла наклона касательной к оси концентраций:
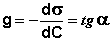 (IV.6)
(IV.6)
Нетрудно заметить, что с ростом концентрации поверхностная активность ПАВ уменьшается. Поэтому поверхностную активность вещества обычно определяют при бесконечно малой концентрации раствора; в этом случае её величина, обозначаемая gо, зависит только от природы ПАВ и растворителя. Исследуя поверхностное натяжение водных растворов органических веществ, Траубе и Дюкло установили для гомологических рядов поверхностно-активных веществ следующее эмпирическое правило:
В любом гомологическом ряду при малых концентрациях удлинение углеродной цепи на одну группу СН2 увеличивает поверхностную активность в 3 – 3.5 раза.
Для водных растворов жирных кислот зависимость поверхностного натяжения от концентрации описывается эмпирическим уравнением Шишковского:
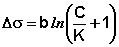 (IV.6a)
(IV.6a)
Здесь b и K – эмпирические постоянные, причём значение b одинаково для всего гомологического ряда, а величина К увеличивается для каждого последующего члена ряда в 3 – 3,5 раза.
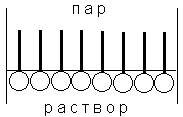
Рис. 4.3 Предельная ориентация молекул ПАВ в поверхностном слое
Молекулы большинства ПАВ обладают дифильным строением, т.е. содержат как полярную группу, так и неполярный углеводородный радикал. Расположение таких молекул в поверхностном слое энергетически наиболее выгодно при условии ориентации молекул полярной группой к полярной фазе (полярной жидкости), а неполярной – к неполярной фазе (газу или неполярной жидкости). При малой концентрации раствора тепловое движение нарушает ориентацию молекул ПАВ; при повышении концентрации происходит насыщение адсорбционного слоя и на поверхности раздела фаз образуется слой "вертикально" ориентированных молекул ПАВ (рис. 4.3). Образование такого мономолекулярного слоя соответствует минимальной величине поверхностного натяжения раствора ПАВ и максимальному значению адсорбции Г (рис. 4.1-4.2); при дальнейшем увеличении концентрации ПАВ в растворе поверхностное натяжение и адсорбция не изменяются.
4.1.3 Адсорбция на границе твердое тело – газ
При адсорбции газов на твердых телах описание взаимодействия молекул адсорбата и адсорбента представляет собой весьма сложную задачу, поскольку характер их взаимодействия, определяющий характер адсорбции, может быть различным. Поэтому обычно задачу упрощают, рассматривая два крайних случая, когда адсорбция вызывается физическими или химическими силами – соответственно физическую и химическую адсорбцию.
Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий. Она характеризуется обратимостью и уменьшением адсорбции при повышении температуры, т.е. экзотермичностью, причем тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата (10 – 80 кДж/моль). Таковой является, например, адсорбция инертных газов на угле.
Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата. Хемосорбция обычно необратима; химическая адсорбция, в отличие от физической, является локализованной, т.е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим энергии активации порядка 40 – 120 кДж/моль, повышение температуры способствует её протеканию. Примером химической адсорбции является адсорбция кислорода на вольфраме или серебре при высоких температурах.
Следует подчеркнуть, что явления физической и химической адсорбции чётко различаются в очень редких случаях. Обычно осуществляются промежуточные варианты, когда основная масса адсорбированного вещества связывается сравнительно слабо и лишь небольшая часть – прочно. Например, кислород на металлах или водород на никеле при низких температурах адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать химическая адсорбция. При повышении температуры увеличение химической адсорбции с некоторой температуры начинает перекрывать падение физической адсорбции, поэтому температурная зависимость адсорбции в этом случае имеет четко выраженный минимум (рис. 4.4).
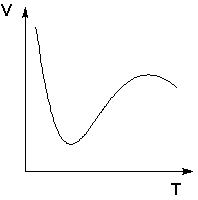
Рис. 4.4 Зависимость объема адсорбированного никелем водорода
от температуры
При постоянной температуре количество адсорбированного вещества зависит только от равновесных давления либо концентрации адсорбата; уравнение, связывающее эти величины, называется изотермой адсорбции.
 2014-02-02
2014-02-02 1891
1891
