| Система | Уравнение | Примечание |
| Индивидуальный идеальный газ | 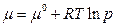
| m 0 – стандартный химический потенциал (при р = 1 атм), m 0 = f(T); R – универсальная газовая постоянная, R = 8,31 Дж/(моль×К); Т – температура, К; p – давление газа |
| Смесь идеальных газов | Хим. потенциал i -го комп-та | рi – парциальное давление газа, рi = xi×p;
xi – мольная доля компонента;
p – общее давление газовой смеси, p = S рi;
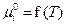 ; ; 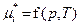
|
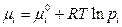 , ,
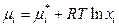
| ||
| Идеальный жидкий раствор | 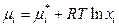
| xi – мольная доля компонента в растворе
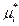 – стандартный хим. потенциал компонента (при xi ®0), – стандартный хим. потенциал компонента (при xi ®0), 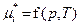
|
| Смесь реальных газов | 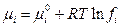
| fi – парциальная фугитивность, или летучесть – фиктивное давление, подбираемое таким образом, чтобы сохранялась форма термодинамических уравнений (fi×V = niRT); fi× = g i×pi, где g i – коэффициент фугитивности. |
| Реальный жидкий раствор | 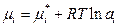
| ai – активность компонента, связана с концентрацией через коэффициент активности g:
ai = g x×xi; ai = g c×ci; ai = g m×mi (c, m – молярная и моляльная концентрации раствора). В бесконечно разбавленных растворах γ → 1, аi → ci (хi или mi).
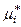 – химический потенциал компонента реального жидкого раствора в стандартном состоянии. – химический потенциал компонента реального жидкого раствора в стандартном состоянии.
|
Существует два основных способа выбора стандартного состояния компонента реального жидкого раствора – симметричный и несимметричный.
Симметричный способ. Выбирается одинаковое стандартное состояние для растворителя и растворенного вещества – состояние чистого компонента при температуре раствора. Способ чаще применяется для растворов неэлектролитов.
Несимметричный способ. Выбирается различное стандартное состояние для растворителя и растворенного вещества. Для растворителя – как и в симметричном способе. Для растворенного веществаза стандартное выбирается состояние вещества в бесконечно разбавленном растворе. Способ наиболее часто используется в термодинамике растворов электролитов.
Раздел II. химическое равновесие
Протекание самопроизвольного процесса в термодинамической системе сопровождается уменьшением свободной энергии системы (d G < 0, d F < 0). При достижении системой минимума свободной энергии устанавливается химическое равновесие, при котором d G = 0 и d F = 0.
Химическое равновесие является динамическим, т.е. соответствует одновременному протеканию процесса в противоположных направлениях с одинаковой скоростью.
Химическое равновесие подвижно – любое бесконечно малое внешнее воздействие на равновесную систему вызывает бесконечно малое изменение ее состояния.
 2014-02-12
2014-02-12 555
555








