Работа расширения газа.
Работа расширения газа, помещенного в рабочую камеру, одна из стенок которой представляет собой незакрепленный поршень, в случае его малого перемещения dx, очевидно, имеет следующий вид:
dA=F×dx=p×S×dx=p×dV
Это элементарная работа расширения газа: внутренний параметр р умножается на элементарное изменение внешнего параметра dV. Заметим, что это выражение элементарной работы никак не связано с формой объёма и останется справедливым в случае, например, раздувающегося резинового шарика.
Энергия поляризованной среды, занимающей объем V, как известно из электростатики, имеет вид:
Wэлектр=V×wэлектр=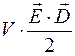
Из двух векторов, характеризующих электрическое поле в среде, вектор 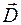 вдали от границ раздела определяется свободными зарядами, т.е. обстоятельствами внешними по отношению к среде. Сброс энергии, связанный с деполяризацией среды из-за элементарного уменьшения внешнего поля
вдали от границ раздела определяется свободными зарядами, т.е. обстоятельствами внешними по отношению к среде. Сброс энергии, связанный с деполяризацией среды из-за элементарного уменьшения внешнего поля 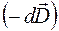 , является элементарной работой, совершенной данной средой над окружающими её свободными зарядами, и имеет вид:
, является элементарной работой, совершенной данной средой над окружающими её свободными зарядами, и имеет вид:
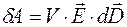 ,
,
где внутренний параметр 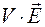 умножается на элементарное изменение внешнего параметра
умножается на элементарное изменение внешнего параметра 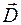 .
.
3. Работа намагниченной среды, связанная с её размагничиванием.
Энергия намагниченной среды, занимающей объем V, как известно из магнитостатики, имеет вид:
Wмагн=V×wмагн=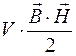
Из двух векторов, характеризующих магнитное поле в среде, вектор 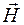 определяется токами свободных зарядов, т.е. обстоятельствами внешними по отношению к среде. Сброс энергии, связанный с размагничиванием среды из-за элементарного уменьшения внешнего поля
определяется токами свободных зарядов, т.е. обстоятельствами внешними по отношению к среде. Сброс энергии, связанный с размагничиванием среды из-за элементарного уменьшения внешнего поля 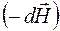 , является элементарной работой, совершенной данной средой над окружающими её свободными токами, и имеет вид:
, является элементарной работой, совершенной данной средой над окружающими её свободными токами, и имеет вид:
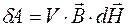 ,
,
где внутренний параметр 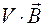 умножается на элементарное изменение внешнего параметра
умножается на элементарное изменение внешнего параметра 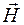 .
.
Из примеров 1,2,3 можно сделать вывод: элементарная работа рассмотренных равновесных систем выражается через произведение внутреннего параметра на элементарное изменение внешнего. Точно также для произвольной равновесной ТД системы каждому внутреннему параметру Bi системы всегда можно найти сопряженный с ним внешний параметр bi так, что элементарная работа равновесной ТД системы над внешним окружением будет определяться следующим соотношением:
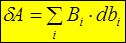 .
.
Т.е., зная выражение элементарной работы равновесной системы, мы знаем все её параметры. Кстати, до тех пор, пока не написано выражение элементарной работы равновесной системы, нельзя сказать какие параметры являются внешними, а какие – внутренними.
Отсюда более общее определение работы.
Определение: мера обмена энергией между ТД системой и ее окружением в процессе, связанном с изменением внешних параметров системы называется работой А.
Достаточно полно охарактеризовав работу, перейдем к теплообмену.
Определение: процесс обмена энергии, не связанный с механическим движением, называется теплообменом. Более общим определением является следующее: теплообмен – это процесс обмена энергии, не связанный с изменением внешних параметров системы.
Определение: мера передачи энергии в процессе теплообмена называется теплом Q.
#4. Температура.
Заданное ТД состояние определяет все физические величины, связанные с этим состоянием, т.е. функции состояния. Из изложенного выше следует, что состояние не может быть задано одним параметром. Следовательно, функции ТД состояния – это функции нескольких аргументов. Из двух параметров равновесного газа p и V можно искусственным образом сконструировать бесконечное множество функций, физический смысл которых будет неясен или вообще его не будет. Становление термодинамики было связано с открытием функций состояния, имеющих физический смысл. Сейчас мы должны рассмотреть первую важнейшую функцию ТД состояния.
Теплообмен между двумя ТД системами возможен, если их приводят в тепловой контакт. ТД система, которая не находится в тепловом контакте ни с какой другой, называется адиабатически изолированной. Две равновесные системы, приведенные в тепловой контакт друг с другом, могут обмениваться теплом, а могут и не обмениваться. В последнем случае говорят, что они находятся в равновесии друг с другом. Задумаемся: в тепловой контакт могут быть приведены совершенно различные системы, равновесные термодинамические параметры которых никак не связаны друг с другом: они могут отличаться как качественно, так и не совпадать по количеству. И, тем не менее, все системы, находящиеся в тепловом равновесии друг с другом должно что-то объединять. Это что-то должно быть общим в их состояниях.
Для каждой равновесной ТД системы существует функция ее ТД параметров, которая для всех систем, находящихся в равновесии друг с другом, имеет одно и то же значение; эта функция называется температурой.
Таким образом, температура может быть определена только в равновесном состоянии ТД системы. Чтобы понятия «большая» и «меньшая температура» имели строго определенный смысл, необходимо добавить, что при получении телом тепла при постоянных внешних параметрах его температура увеличивается.
Из опыта известен следующий факт: если зафиксировать все внешние параметры системы в термостате, то в ней со временем установится единственно возможный набор равновесных внутренних параметров. Следовательно, в равновесном ТД состоянии все внутренние параметры однозначно определяются внешними параметрами и температурой.
#5. Уравнение состояния.
Соотношения, связывающие температуру и параметры равновесного ТД состояния, называются уравнениями состояния.
Данная масса определенного газа в сосуде в отсутствие внешних полей в состоянии теплового равновесия является ТД системой всего с двумя ТД параметрами: давлением р и объемом V. В термодинамике идеальным газом называется система, уравнением состояния которой является уравнение Менделеева-Клапейрона:
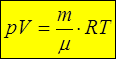
Температура, фигурирующая в этом равенстве, называется идеально-газовой или абсолютной.
Реальным газом определенной массы и определенного химического состава называется система, уравнением состояния которой является уравнение Ван-дер-Ваальса:
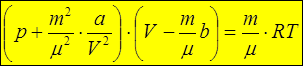
Здесь коэффициенты Ван-дер-Ваальса a и b зависят только от химической природы газа. Температура здесь также является абсолютной.
Физический смысл коэффициентов невозможно прояснить без ссылки на молекулы, из которых состоит газ: а характеризует их притяжение друг к другу, а b - молекулярный объём. Но необходимо отметить, что ТД не "снисходит" до микроскопического строения своих объектов. Понятия "атом", "молекула" не существуют в ТД. В своих построениях этот раздел тепловой физики использует только макроскопические величины, природа которых либо проясняется на основе непосредственного опыта, либо вообще не проясняется никак. ТД является феноменологической наукой.
Кстати, под словом "макроскопическое" нужно понимать нечто соразмерное с человеком и с его органами чувств; то, что воспринимается органами чувств человека непосредственно. Для нашего изложения актуальным является вопрос границы между макроскопикой и микроскопикой. Иными словами, какие макроскопические тела самые малые? Ответ: это объекты, видимые в оптический микроскоп: неживые броуновские частицы и живые биологические клетки. То, что визуализуется с помощью видимого света. К этому можно добавить, что это самые мелкие системы, способные обладать температурой.
 2014-02-12
2014-02-12 437
437







