Ртуть — серебристо-белый металл, в парах бесцветный. Единственный жидкий при комнатной температуре металл. Твердая ртуть — бесцветные кристаллы октаэдрической формы, существующая в двух кристаллических модификациях. Жидкая ртуть не смачивает стекло и практически не растворяется в воде.
Кислород и сухой воздух при обычных условиях ртуть не окисляют. Влажный воздух и кислород при ультрафиолетовом облучении или электронной бомбардировке окисляют ртуть с поверхности с образованием оксидов. Ртуть окисляется кислородом воздуха при температуре выше 300°C, образуя оксид ртути HgO красного цвета: 2Hg + O2 = 2HgO. Выше 340°C этот оксид разлагается на простые вещества.
При комнатной температуре ртуть окисляется озоном. С разбавленными кислотами ртуть не реагирует, но растворяется в царской водке и в азотной кислоте. Причем, в случае с кислотой продукт реакции зависит от концентрации кислоты и соотношения ртути и кислоты. При избытке ртути, на холоде, протекает реакция: 6Hg + 8HNO3разбавл. = 3Hg2(NO3)2 + 2NO + 4H2O.
|
|
|
При избытке кислоты: 3Hg + 8HNO3 = 3Hg(NO3)2 + 2NO + 4H2O.
С галогенами ртуть активно взаимодействует с образованием галогенидов. При реакциях ртути с серой, селеном и теллуром возникают халькогениды HgS, HgSe, HgTe. Эти халькогениды практически не растворимы в воде. Сплавы ртути с металлами называют амальгамами. Амальга́ма (ср.-век. лат. amalgama — сплав) — жидкие или твёрдые сплавы ртути с другими металлами. Также амальгама может быть раствором, ведущих себя аналогично металлам, ионных комплексов (например, аммония). Получение Получают взаимодействием металла с ртутью (при смачивании ртутью поверхности металла) при обычных температурах или подогреве, электролитическим выделением металла или катионного комплекса на ртутном катоде или другими способами. Многие металлы образуют со ртутью устойчивые соединения.
Свойства При нагревании амальгам меди, серебра, золота и др. отгоняется ртуть.
Железо не образует амальгамы, поэтому ртуть можно перевозить в стальных сосудах.
Применение Амальгаму используют при золочении металлических изделий, в производстве зеркал, а также в люминесцентных лампах, в том числе компактных энергосберегающих люминесцентных ламп и индукционных лампах. Амальгамы щелочных металлов и цинка в химии применяют как восстановители. Амальгаму применяют при холодной сварке в микроэлектронике. Раньше амальгама серебра применялась в стоматологии в качестве материала зубных пломб. Стойкие к амальгамированию металлы — железо, ванадий, молибден, вольфрам, ниобий и тантал. Со многими металлами ртуть образует интерметаллические соединения меркуриды. Ртуть образует два оксида: оксид ртути(II) HgO и неустойчивый на свету и при нагревании оксид ртути(I) Hg2O (черные кристаллы). HgO образует две модификации — желтую и красную, отличающиеся размерами кристаллов. Красная модификация образуется при добавлении к раствору соли Hg2+ щелочи:Hg(NO3)2 + 2NaOH = HgOЇ + 2NaNO3 + H2O.
|
|
|
Желтая форма химически более активна, при нагревании краснеет. Красная форма при нагревании чернеет, но приобретает прежний цвет при охлаждении. При добавлении щелочи к раствору соли ртути(I) образуется оксид ртути (I) Hg2O: Hg2(NO3)2 + 2NaOH = Hg2O + H2O + 2NaNO3.
На свету Hg2O распадается на ртуть и HgO, давая осадок черного цвета.
Для соединений ртути(II) характерно образование устойчивых комплексных соединений:
2KI + HgI2 = K2[HgI4],
2KCN + Hg(CN)2 = K2[Hg(CN)4].
Соли ртути(I) содержат группировку Hg22+ со связью –Hg–Hg–. Получают эти соединения, восстанавливая соли ртути(II) ртутью: HgSO4 + Hg + 2NaCl = Hg2Cl2 + Na2SO4,
HgCl2 + Hg = Hg2Cl2.
В зависимости от условий, соединения ртути(I) могут проявлять как окислительные, так и восстановительные свойства: Hg2Cl2 + Cl2 = 2HgCl2,
Hg2Cl2 + SnCl2 = 2Hg + SnCl4.
Пероксид HgO2 — кристаллы; неустойчив, взрывается при нагревании и ударе.
Оксид ртути(II) — бинарное соединение ртути и кислорода с формулой HgO. Это твёрдое непрочное при нормальных условиях вещество в зависимости от дисперсности красного или оранжевого (жёлтого) цвета является основным и важнейшим оксидом ртути и практически не встречается в природе, за исключением редкого минерала монтроидита.
Получение Красный оксид ртути получают нагреванием ртути до 350 °C или пиролизом нитрата ртути. 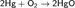 Жёлтый оксид получают осаждением солей ртути(II) щелочами, например:
Жёлтый оксид получают осаждением солей ртути(II) щелочами, например: 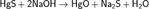 Разница в цвете объясняется размером частиц, обе формы имеют одинаковую структуру — цепь линейных звеньев состава O-Hg-O соединённых под углом 108°. Размеры частиц жёлтого оксида ртути составляют до 4 мкм, красной — более 8 мкм.
Разница в цвете объясняется размером частиц, обе формы имеют одинаковую структуру — цепь линейных звеньев состава O-Hg-O соединённых под углом 108°. Размеры частиц жёлтого оксида ртути составляют до 4 мкм, красной — более 8 мкм.
Свойства Жёлтый HgO является более химически активным, разлагается при температуре 332oC, при нагревании краснеет. Красный HgO распадается при 500, а при нагревании обратимо меняет свой цвет на чёрный.Оксид ртути(II) в воде малорастворим. Проявляет слабые основные свойства.
Растворяется в концентрированных растворах щелочей. Жёлтый HgO взаимодействует с NH3 с образованием основания Миллона: 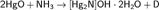
Оксиды и гидроксиды цинка и кадмия. Получение. Кислотно-основные свой-ства. Соли. Кристаллогидраты. Соли цинка в катионной и анионной формах. Гидролиз солей цинка и кадмия. Цинкаты и кадматы. Комплексные соединения цинка и кадмия.
Оксид цинка (II) ZnO – белые кристаллы, при нагревании приобретают желтую окраску, кристаллизуются в гексагональной сингонии. Плотность 5,7 г/см3, температура возгонки 1800°С. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом:
ZnO + C = Zn + CO;
ZnO + CO = Zn + CO2;
ZnO + H2 = Zn + H2O.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO + 2HCl = ZnCl2 + H2O;
ZnO + 2NaOH + H2O = Na2[Zn(OH)4].
При сплавлении с оксидами металлов образует цинкаты: ZnO + CoO = CoZnO2.
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 = Zn2SiO4,
ZnO + B2O3 = Zn(BO2)2.
Получается при горении металлического цинка: 2Zn + O2 = 2ZnO;
при термическом разложении солей: ZnCO3 = ZnO + CO2.
Гидроксид цинка (II) Zn(OH)2 – бесцветное кристаллическое или аморфное вещество, существует в пяти полиморфных модификациях, устойчивой является только ромбическая ε-Zn(OH)2. Плотность 3,05 г/см3, при температуре выше 125°С разлагается:
Zn(OH)2 = ZnO + H2O.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O;
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4];
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
|
|
|
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl. Аутокомплексообразование.
Оксид и гидроксид кадмия:
а) оксид (CdO). Порошок более или менее коричневато–желтого цвета в зависимости от температуры прокаливания в процессе его получения из карбоната или гидроксида. Используется в производстве керамики и как катализатор;
б) гидроксид(Cd(ОН)2). Белый порошок.
 2015-01-30
2015-01-30 5984
5984
