Известно, что одни химические реакции протекают за малые доли секунды, другие же — за минуты, часы, дни. Например, практически мгновенно протекают реакции, которые сопровождаются взрывным эффектом: горение пороха, воспламенение горючей смеси в двигателе внутреннего сгорания автомобиля. При сливании растворов хлорида бария и серной кислоты мгновенно образуется белый осадок сульфата бария:
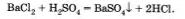
Наоборот, реакция ржавления железа (коррозия) идет так медленно, что проследить за ее результатами можно лишь по истечении длительного времени.
Одна и та же реакция может в одних условиях протекать быстро, а в других — медленно. Например, процесс окисления серебра или меди на воздухе тянется годами, а в присутствии озона проходит чрезвычайно быстро. Чтобы характеризовать быстроту течения химической реакции, пользуются понятием скорость химической реакции, которая обозначается латинской буквой v.
Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени.
Запишем формулу, по которой можно найтн скорость реакции:
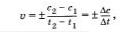
где с2 и с1 — молярные концентрации реагирующих или образующихся веществ, соответственно, в момент времени t2, t1. Если скорость реакции характеризуют изменением молярной концентрации исходных (реагарующих) веществ, то t2>t1, а с2<с1 (концентрация исходного вещества убывает по мере протекания реакции). Так как скорость реакции имеет положительное значение, перед дробью следует поставить знак минус.
Количество вещества в единице объема называется его молярной концентрацией. Она измеряется в моль/л. Так как время измеряется в секундах (минутах, часах), то можно вывести и единицы измерения скорости химической реакции: 1 моль/л * с; 1 кмоль/м3 • мин и т. д.Следовательно, чтобы определить, с какой скоростью протекает химическая реакция, нужно знать: а) какое количество вещества образуется (для продукта реакции) или расходуется (для исходного вещества); б) за какое время это происходит и в) в каком объеме протекает реакция.
Знание скоростей химических реакций имеет очень большое практическое и научное значение. Например, в химической промышленности от скорости химической реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта и, в конечном итоге, зарплата работников и себестоимость продукции.
Раздел химии, изучающий скорость химической реакции, называется кинетикой. Зная ее законы, человек получает возможность управлять химическими процессами, им требуемую скорость.
При рассмотрении вопросa о скорости реакции необходимо помнить, что реакции в химии делятся на гомогенные и гетерогенные.
Реакции, которые протекают в однородной среде (нет поверхности раздела реагирующих веществ), например в си газов или в растворах, называются гомогенными (от греч. голо — «равный, одинаковый»).
Гетерогенными называются реакции, которые идут между веществами в неоднородной среде (есть поверхность раздела реагирующих веществ). Например.
На поверхности соприкосновения твердого вещества и жидкости, газа и жидкости, твердого вещества и газа и т. д. (от греч. гетеро - «разный, другой»).
Данное выше определение и соответствующая ему формула скорости химической реакции справедливы для гомогенных реакций.
Если реакция гетерогенная, то она может идти только на поверхности раздела реагирующих веществ. В этом случае скорость химической реакции Будет определяться площадью поверхности соприкосновения реагирующих веществ.Следовательно, для гетерогенных реакций одним из факторов, которые определяют скорость химической реакции, является величина площади поверхности соприкосновения реагирующих веществ.
Поэтому на производстве столь часто проводятся химические реакции в "кипящем слое". Твердое вещество для этой цели мелко дробят.
Измельчают почти до состояния пыли, а затем черед него пропускают снизу второе вещество, как правило, газ. Прохождение его через мелкораздробленное первое вещество-peaгент сопровождается иллюзией кипения. Например, в «кипящем слое» осуществляется обжиг мелко измельченного серного колчедана при производстве серкой кислоты.
На скорость химической реакции оказывает влияние природе металла. А влияет ли на скорость реакции аналогично и ирнрола второго реагента — кислоты?
Проделаем второй опыт. Опустим в пробирки по одной грануле цинка и прильем в первую — 2 мл уксусной кислоты, а во вторую — 2 мл соляной кислоты одинаковой молярной концентрации. Нетрудно заметить, что скорость реакции взаимодействия цинка с соляной кислотой выше, чем скорость взаимодействия цинка с уксусной кислотой.
Влияние природы веществ на скорость химических реакций очень велико. Например, процесс превращения гранита в глину, тек называемое выветривание горных пород, протекает на протяжении тысячелетий. Природа бутылочного или оконного стекла, полиэтилена и других веществ, созданных человеком, такова, что эти вещества практически не разлагаются или разлагаются чрезвычайно медленно.
Вот и приходится человеку находить способы их утилизации, например сжигать. И как мудро распорядилась эволюция, когда предусмотрела для человека и большинства животных в качестве транспортирующего кислород вещества гемоглобин крови, который уже при комнатной температуре способен соединяться с кислородом воздуха со значительной скоростью, а следовательно, и быстро доставлять его из легких в тканях.
Слелующим важнейшим фактором, влияющим на скорость химической реакции, является концентрация {содержание) реагирующих веществ.
Проделаем опыт, показывающий это влияние. Нальем в три пробирки раствор тиосульфата натрия, который ребятам, занимающимся фотографией, известен иод названием фиксажа. В первую пробирку — 3 мл. во вторую — 2 мл и в третью — 1 мл. Затем прильем во все пробирки воды так, чтобы уровень растворов тиосульфата в них стал одинаковым — 5 мл. то есть в первую пробирку прильем 2 мл воды, во вторую — 3 мл. а в третью — 4 мл.
Понятно, что наибольшей будет концентрация раствора тиосульфата н первой пробирке, а наименьшей — в третьей. Теперь быстро прильем в каждую пробирку (начиная с третьей) по 2 мл раствора серной кислоты и проследим, в какой из них раньше всего выпадет осадок серы. Раньше всего он образуется там. где выше концентрация тиосульфата, то есть в первой пробирке. Это и понятно. Ведь для химического взаимодействия серной кислоты и тиосульфата необходимо, чтобы частички (ионы), из которых они состоят, столкнулись. Чем больше число столкновений, тем быстрее протекает реакция. А число столкновений тем больше, чем больше концентрация реагирующих веществ, то есть количества, или массы, этих веществ в единице объема.
На основании обширного экспериментального материала в 1867 г. норвежские ученые К. Гульдберг и П. Вааге сформулировали основной химической кинетики, который устанавливал зависимость скорости химической реакции от концентрации реагирующих веществ.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам.
Скорость простой (злементарной), протекающей в одну стадию реакции и записанной в общей форме
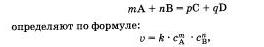
где v — скорость реакции, C A — молярная концентрация вещества А, C B — молярная концентрация вещества В, m n их коэффициенты, а k — константа, которая равна скорости реакции при концентрации реагирующих веществ 1 моль/л (справочная величина).
Этот закон называют также законом действующих масс. Он не распространяется на вещества, находящиеся в твердом состоянии, так как считается, что их концентрация постоянна, нескольку они реагируют лишь на поверхности, которая, как считается, остается практически неизменной (гетерогенная реакция).
Например, рассмотрим реакцию взаимодействия меди с кислородом:
2Сu + О2 = 2СuО.
Скорость этой реакции пропорциональна концентрации кислорода, так как соударения можду молекулами кислорода и меди могут происходить только на поверхности раздела веществ, а значит, масса меди не влияет на скорость реакции.
Зависимость скорости химической реакции от температуры определяется правилом Вант Гоффе (1884):
При повышении температуры на каждые 10° С скорость реакции увеличивается в 2—1 раза.
Впервые в истории науки Вант-Гоффу была вручена Нобелевская прения по химии.
Взаимнодействие водорода и кислороде при комнатной температуре почти не происходит - так мала скорость реакции. При 500 °С эта реакция протекает всего эа 50 мин. а при 700 °С она происходит почти мгновенно:
H2+O2 = 2H2O
Математически правило Вант-Гоффа записывается следующей формулой:
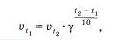
Правило ВантГоффа является приближенным и применяется лишь для ориентировочной оценки влияния температуры на скорость реакции. Згу зависимость также легко проверить опытным путем. Нальем н три химических стаканчика одинаковые объемы раствора тиосульфата натрия. Одинаковые растворы серной кислоты, которые мы одновременно будем приливать в эти стаканчики ні трех пробирок, нагреем до разных температур: в первой пробирке оставим раствор комнатной температуры: вторую пробирку нагреем до 40 °С. а третью -до 70 °С. Нетрудно заметить, что вначале помутнеет раствор тиосульфата, к которому прилили самый горячий раствор кислоты, потом — теплый в. наконец. — раствор тиосульфата натрии, к которому придали раствор серной кислоты комнатной температуры.
Итак, мы выяснили, что скорость химической реакции зависит от следующих факторов: от природы реагирующих веществ, концентрации, температуры, площади соприкосновения реагирующих веществ (для гетерогенных реакций).
действующих масс), 3. Зависимость скорости химической реакции от температуры — правило Ваит-Гоффа.
 2015-01-30
2015-01-30 1489
1489
