Откуда же взялась теплота в реакции горения метана? Значит она была скрыта в молекулах СН4 и О2, а теперь высвободилась.
Приведем пример более простой реакции:
2Н2+О2=2Н2О+Q
Значит энергетический уровень стехиометрической смеси водорода с кислородом был выше, чем у продукта реакции Н2О и «лишняя» энергия вы-свободилась из вещества.
При обратной реакции электролиза воды, т.е. разложения воды с помощью электрической энергии, происходит перераспределение атомов в молекуле воды с образованием водорода и кислорода. При этом теплосодержание Н2 и О2 повышается.
Таким образом, каждое вещество при его образовании получает или отдаст определенную энергию, и мера тепловой энергии, накапливаемой веществом при его образовании, называется теплосодержанием, или энтальпией.
В отличие от химии, в химической термодинамике теплота образования вещества обозначается не символом Q, а символом DН со знаком (+), если теплота поглощается химическим соединением, и со знаком (-), если теплота выделяется при реакции, то есть «уходит» из системы.
Стандартная теплота образования 1 моля вещества при давлении 101,3 кПа и температуре 298 К обозначается 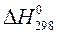 .
.
В справочниках даны теплоты образования 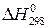 соединений из про-стых веществ.
соединений из про-стых веществ.
Например:
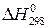 у СО2 = - 393,5 кДж/моль
у СО2 = - 393,5 кДж/моль
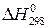 у Н2Огаз = - 241,8 кДж/моль
у Н2Огаз = - 241,8 кДж/моль
Но у веществ, образующихся при эндотермических процессах, напри-мер, 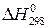 ацетилена С2Н2 = +226,8 кДж/моль, при образовании атома водо-рода Н+ по реакции Н2= Н++ Н+
ацетилена С2Н2 = +226,8 кДж/моль, при образовании атома водо-рода Н+ по реакции Н2= Н++ Н+ 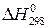 =+217,9 кДж/моль.
=+217,9 кДж/моль.
Для чистых веществ, состоящих из одного химического элемента в ус-тойчивой форме (Н2, О2, С, Na и др.) DН условно принята равной нулю.
Теплосодержание можно назвать химической энергией, так как его ве-личина тесно связана с химическим составом вещества.
Однако, если мы обсуждаем макроскопические свойства веществ, то выделяем несколько форм энергии: кинетическую, потенциальную, химическую, электрическую, тепловую, ядерную энергии и механическую работу. А если рассматривать вопрос на молекулярном уровне, то эти формы энергии можно объяснить исходя лишь из двух форм – кинетической энергии движения и потенциальной энергией покоя атомов и молекул.
При химических реакцияхизменяются только молекулы. Атомы оста-ются неизменными. Энергия молекулы – это энергия связи ее атомов, нако-пленная в молекуле. Она определяется силами притяжения атомов друг к другу. Кроме того, существует потенциальная энергия притяжения молекул друг к другу. В газах она мала, в жидкостях больше и еще больше в твердых телах.
Каждый атом обладает энергией, часть которой связана с э лектронами, а часть – с ядром. Электроны обладают кинетической энергией вращения вокруг ядра и потенциальной электрической энергией притяжения друг к другу и отталкивания друг от друга.
Сумма этих форм молекулярной энергии и составляет теплосодержание молекулы.
Если просуммировать теплосодержание 6,02×1023 молекул вещества, то получим молярноетеплосодержание этого вещества.
Почему теплосодержание одноэлементных веществ (молекул одного элемента) взято за ноль, можно пояснить следующим образом.
DН химического элемента, то есть энергия его образования, связана с внутриядерными процессами. Ядерная энергия связана с силами взаимодей-ствия внутриядерных частиц и превращением одного химического элементав другой при ядерных реакциях. Например, реакция распада урана:
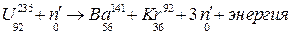
или проще: U+n®Ba+Kr+3n.
где: n’o – нейтронная частица с массой 1 и нулевым зарядом.
Уран захватывает нейтрон, в результате чего расщепляется (распадает-ся) на два новых элемента – барий и криптон – с образованием 3х нейтронов, и выделяется ядерная энергия.
Следует сказать, что с ядерными реакциями связаны в миллионы раз большие изменения энергии, чем при химических реакциях. Так, энергия распада урана составляет 4,5×109 ккал/моль×урана. Это в 10 млн. раз больше, чем при сгорании одного моля угля.
В химических реакциях атомы не изменяются, а изменяются молекулы. Поэтому энергия образования атомов химиками не учитывается, и DН одно-элементных газовых молекул и атомов чистых веществ принята равной нулю.
Приведенная реакция распада урана – это классический пример цепной реакции. Теорию цепного механизма реакции горения мы будем рассматри-вать позднее. А вот откуда берется нейтрон и что заставляет его реагировать с ураном – это связано с так называемой энергией активации, которую рассмотрим чуть позднее.
 2015-01-30
2015-01-30 1507
1507







