Групповой реагент – смесь равных объемов 1 моль/л растворов солей кальция и бария (рН > 7). Применяется с целью достижения полноты осаждения, так как одни анионы образуют наименее растворимые соли с катионами кальция, а другие – бария.
Фосфат-, сульфат- и борат-анионы образуют малорастворимые бариевые соли белого цвета
2РО 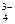 + 3Ва2+ = Ва2(РО4)2↓
+ 3Ва2+ = Ва2(РО4)2↓
SO 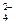 + Ва2+ = BaSO4↓
+ Ва2+ = BaSO4↓
2ВО 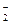 + Ва2+ = Ва(ВО2)2↓,
+ Ва2+ = Ва(ВО2)2↓,
растворимые в разбавленных минеральных кислотах, за исключением BaSO4, который растворим только в концентрированной H2SO4 и, частично, в растворе трилона Б, а Ва(ВО2)2 растворим также в СН3СООН.
BaSO4↓ + H2SO4 (конц.) = Ba(HSO4)2
Оксалат- и фосфат-анионы образуют малорастворимые кальциевые соли белого цвета, растворимые в разбавленных минеральных кислотах.
С2О 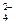 + Са2+ = СаС2О4↓
+ Са2+ = СаС2О4↓
2РО 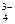 + 3Са2+ = Са3(РО4)2↓
+ 3Са2+ = Са3(РО4)2↓
Анионы второй группы не образуют летучих продуктов при действии разбавленных кислот (отличие от анионов первой группы).
Осадки, образованные этими анионами с AgNO3, растворимы в 2 моль/л HNO3 (отличие от анионов третьей группы).
При действии на нейтральные растворы анионов второй аналитической группы раствором AgNO3 образуются осадки, растворимые в HNO3 и NH4OH.
РО 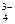 + 3Ag+ = Ag3РО4↓ – желтый осадок
+ 3Ag+ = Ag3РО4↓ – желтый осадок
С2О 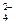 + 2Ag+ = Ag2С2О4↓ – белый осадок
+ 2Ag+ = Ag2С2О4↓ – белый осадок
B4O 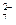 + 2Ag+ + 3H2O = 2H3BO3 + AgВО2↓ – белый осадок
+ 2Ag+ + 3H2O = 2H3BO3 + AgВО2↓ – белый осадок
Сульфат-анион образует осадок только из концентрированных растворов
SO 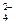 + 2Ag+ = Ag2SO4↓ – белый осадок
+ 2Ag+ = Ag2SO4↓ – белый осадок
Пример уравнения реакции растворения серебряных солей в растворе аммиака:
Ag3РО4↓ + 6NH4OH = [Ag(NH3)2]3PO4 + 6H2O
Все анионы второй аналитической группы, кроме оксалат-иона, по окислительно-восстановительным свойствам являются индифферентными.
 2015-01-30
2015-01-30 1287
1287
