Пример 1: Вычисление скорости реакции по концентрациям реагирующих веществ.
Реакция между веществами А и В протекает по уравнению 2А + В = С; концентрация вещества А равна 6 моль/л, а вещества В - 5 моль/л. Константа скорости реакции равна 0,5 л2∙моль -2∙с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45 % вещества В.
Решение:
Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Следовательно, для
уравнения реакции в нашем примере
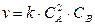
Скорость химической реакции в начальный момент равна
v = 0,5∙ 6 2 ∙5 = 90,0 моль ∙с -1∙ л -1
По истечении некоторого времени в реакционной смеси останется 45 % вещества В. т. е. концентрация вещества В станет равной 5,0∙0,45= 2,25 моль/л. Значит, концентрация вещества В уменьшилась на 5,0 - 2,25 = 2,75 моль/л. Так как вещества А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества А уменьшилась на 5,5 моль/л (2,75∙ 2) и стала равной 0,5 моль/л (6,0 - 5,5). Следовательно, v2 = 0,5∙(0.5)2 ∙ 2,25 = 0,28 моль∙с -1∙л -1.
Пример 2:
Как изменится скорость прямой реакции 2СО + О2 = 2СО2 если общее давление в системе увеличить в 4 раза?
Решение:
Увеличение давления в системе в 4 раза вызовет уменьшение объема системы в 4 раза, а концентрация реагирующих веществ возрастет в 4 раза. Согласно закону действующих масс начальная скорость реакции равна
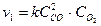
после увеличения давления
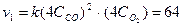
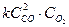
После увеличения давления в 4 раза скорость реакции возросла в 64 раза.
 2015-01-07
2015-01-07 7391
7391
