Скорость химических реакций зависит от многих факторов, главными из которых являются концентрация и природа исходных веществ, температура реакционной системы и присутствие в ней катализатора.
Кроме того, скорость гетерогенных реакций зависит еще и от величины поверхности раздела фаз (чем ее площадь больше, тем скорость реакции выше). Если в реакции участвуют твердые вещества, то можно сравнительно легко увеличить площадь поверхности раздела за счет их измельчения (диспергирования).
Влияние концентрации исходных веществ на скорость химической реакции математически описывается с помощью её основного кинетического уравнения. Для образования продуктов реакции необходимо, в первую очередь, чтобы молекулы исходных веществ столкнулись между собой. Чем больше таких соударений (или единичных актов реакции) происходит в единицу времени, тем скорость реакции будет выше. Частота столкновений между молекулами реагентов напрямую зависит от их числа в единице объема реакционной системы, т.е. от концентрации.
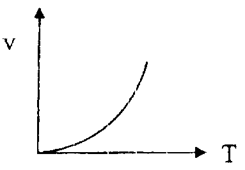
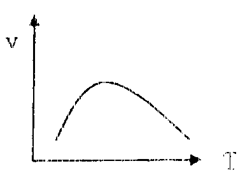
Кроме концентрации реагирующих веществ, важнейшим фактором, влияющим на скорость реакции, является температура реакционной смеси. Причем для большинства химических реакций наблюдается возрастание их скорости с повышением температуры (рис. 41а). Такой тип температурной зависимости скорости реакции называется нормальным. Он характерен для всех простых реакций. Более сложная зависимость от температуры наблюдается для ферментативных реакций, протекающих in vivo или in vitro (рис. 41б). Более подробно о ее причине будет сказано нами позже.
а б
Рис. 41. Зависимость скорости различных типов реакций от температуры: а – нормальная, б – для ферментативных реакций
Увеличение скорости химической реакции с ростом температуры, на первый взгляд, можно объяснить возрастанием скорости теплового движения молекул исходных веществ. Это должно приводить к увеличению числа соударений между ними, несмотря на то, что общее количество молекул осталось неизменным.
Однако, как показали расчёты, число соударений между частицами, находящимися в газовых и жидких средах за единицу времени, всегда достаточно велико. Так, в 1 см3 газа (при н.у.) за одну секунду происходит ~ 1 · 1028 столкновений между молекулами. Если бы каждое из них приводило к образованию конечных продуктов, то подавляющее большинство химических реакций протекали бы практически мгновенно, т.е. со взрывом.
На практике этого не наблюдается, т.к. не все соударения между молекулами исходных веществ являются «успешными». Установлено, что для многих реакций число таких «успешных» соударений ~ в 1015–1020 раз меньше, чем общее число соударений.
Протекание реакции становится возможным только в том случае, если столкнувшиеся молекулы обладают достаточным запасом внутренней энергии. Если её значение равно какой-то определённой величине или больше её, то реакция осуществится (в противном случае – нет). Такие молекулы называются активными, а соударения между ними – эффективными.
Обычно доля активных молекул реагентов, по сравнению с их общим числом, для большинства реакций невелика.
При повышении температуры увеличивается запас внутренней энергии молекул. Всё большее их число становятся активными. Как следствие этого, возрастает доля эффективных соударений между молекулами за единицу времени, а значит и скорость химической реакции.
При повышении температуры концентрации исходных веществ в реакционной смеси практически не изменяются. Значит, увеличение скорости реакции в соответствии с главным кинетическим уравнением должно быть связано с возрастанием её константы скорости.
Голландский учёный Вант-Гофф опытным путём определил, что для химических реакций (имеющих нормальный тип зависимости скорости от температуры) при повышении температуры на каждые 10 градусов величина константы скорости возрастает в 2-4 раза. Причём для каждой химической реакции это число является постоянным и может принимать из указанного интервала как целочисленные (2, 3, 4) значения, так и дробные. Оно определяется экспериментально, называется температурным коэффициентом скорости химической реакции или коэффициентом Вант-Гоффа и обозначается греческой буквой γ:
γ = 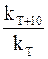
где kТ – константа скорости химической реакции при температуре, равной Т; kT+10 – константа скорости химической реакции при температуре, повышенной, по сравнению с исходной, на 10 градусов.
Согласно правилу Вант-Гоффа, температурный коэффициент γ для химической реакции должен оставаться постоянным в любом температурном диапазоне. Однако в действительности для многих реакций при высоких температурах наблюдается постепенное уменьшение его значения с ростом Т (рис. 42), вплоть до единицы. Поэтому правило Вант-Гоффа справедливо лишь в сравнительно узком интервале температур: от 0°С до 300°С.
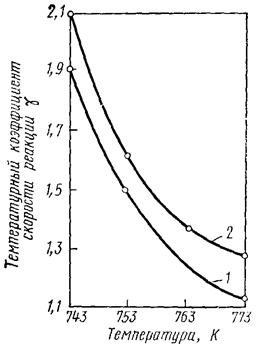
Рис. 42. Зависимость температурного коэффициента скорости
реакции от температуры для реакции образования (1) и
разложения (2) HI (I2 + H2 «2HI)
Более точная зависимость константы скорости химической реакции от температуры была найдена Аррениусом:
k = A · 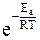
где А – предэкспоненциальный множитель; Еа – энергия активации химической реакции.
Множитель А отражает долю эффективных соударений между молекулами исходных веществ в общем их числе.
Очевидно, что его значения должны находиться в интервале от 0 до 1. При А = 1 все соударения оказываются эффективными. При А = 0 химическая реакция не протекает, несмотря на столкновение между молекулами реагентов.
Истинное значение множителя А для реакции обычно значительно меньше единицы, поскольку не всякое соударение молекул (даже обладающих энергией, равной или большей, чем Еа) обязательно приведёт к образованию продуктов. Столкнувшиеся активные молекулы могут не прореагировать по той причине, что не были должным образом сориентированы в пространстве друг относительно друга. Особенно сильно данный стерический фактор проявляется в превращениях биомолекул, где изменению (трансформации) подвергается лишь сравнительно небольшой их участок.
Соударение может быть неэффективным и из-за того, что перераспределение энергии внутри столкнувшихся молекул осуществляется без их химического изменения, т.е. без разрушения химических связей внутри них.
Энергию активации химической реакции (Еа) по физическому смыслу можно определить как тот избыток энергии, по сравнению со средней энергией неактивных молекул исходных веществ в реакционной системе при данной температуре, который им нужно сообщить, чтобы столкновения между ними привели к химической реакции.
Минимальный запас энергии, которым должны обладать молекулы для вступления в ту или иную реакцию, можно рассматривать как своеобразный энергетический барьер этой реакции.
Причём, чем он выше, тем меньшее число молекул способно его преодолеть. Зная общее число молекул в системе и величину энергии активации для данной реакции, количество таких активных молекул можно рассчитать по закону Максвелла-Больцмана
Na= No ∙ 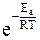
где Na – число активных молекул, No – общее число молекул.
При протекании химической реакции число активных молекул вследствие их расходования уменьшается. Но при этом в результате столкновений между неактивными молекулами исходных веществ происходит перераспределение энергии, в результате чего доля активных молекул Na/No непрерывно восстанавливается и реакция не прекращается.
Величина энергии активации зависит от типа и прочности связей между атомами в молекулах исходных веществ и от характера взаимодействия, в которое они вступают. Таким образом, каждая химическая реакция характеризуется определённой величиной энергии активации. Её значение может быть меньше энергии разрыва связей в молекуле реагента, т.к. для того, чтобы молекула смогла провзаимодействовать, во многих случаях и не требуется полного разрыва связей, а достаточно лишь их ослабления.
Для большинства химических реакций величина Еа изменяется в пределах от 20 до 300 кДж/моль. Низкие значения энергии активации соответствуют высоким скоростям протекания реакции и наоборот.
Опытным путём было установлено, что если величина
Еа < 40 кДж/моль, то реакция протекает мгновенно; если величина Еа изменяется в пределах 40-120 кДж/моль, реакция идёт с измеримой скоростью; при Еа >120 кДж/моль скорость реакции становится очень малой.
Влияние величины энергии активации на скорость химической реакции рассматривается в рамках теории переходного состояния или активированного комплекса.
Она основана на предположении, что в ходе взаимодействия начальная конфигурация частиц реагентов переходит в конечную в результате непрерывного изменения межатомных расстояний.
 2014-02-09
2014-02-09 11414
11414
