Массообменом называется процесс, в результате которого вещество переносится из одного места пространства в другое.
Массообмен наблюдается в системах, состоящих из нескольких компонентов, концентрация в которых неодинакова в различных точках системы.
Наибольший интерес в холодильной, криогенной технике и кондиционировании воздуха представляют те массообменные процессы, которые протекают в системах, состоящих из нескольких фаз (газообразных, парообразных, жидкостных, твердого тела).
Перенос массы рассматриваемого компонента внутри каждой из фаз может осуществляться двумя способами: молекулярной диффузией и конвективной диффузией.
Молекулярная диффузия может быть концентрационной, термо-и бародиффузией.
Концентрационная диффузия. Основныезаконы
Под концентрационной диффузией будем понимать такой вид молекулярной диффузии, в котором перенос массы происходит в системе, имеющей во всех точках одинаковую температуру и одинаковое давление, но различные концентрации масс компонентов.
Первый закон Фика
Связь между количеством в кг, перемещающегося i го компонента вещества, обуславливаемое молекулярной диффузией, и полем его концентрации устанавливается 1 ым законом Фика
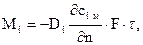 (4.1)
(4.1)
где 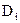 – коэффициент молекулярной диффузии i го компонента, м2/с;
– коэффициент молекулярной диффузии i го компонента, м2/с; 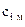 – массовая концентрация i го компонента в единице объема (или его плотность
– массовая концентрация i го компонента в единице объема (или его плотность  ), кг/м3;
), кг/м3; 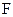 – площадь изоконцентрационной поверхности, м2;
– площадь изоконцентрационной поверхности, м2;  – время процесса, с.
– время процесса, с.
Для плотности потока массы кг/(м2·с) i го компонента 1 ый закон Фика запишется следующим образом
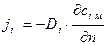 . (4.2)
. (4.2)
Знак "минус" в (4.1) и (4.2) указывает на то, что количество массы и плотности массового потока i го компонента направлены в противоположную сторону от направления градиента концентрации.
Коэффициент молекулярной диффузии 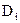 зависит от физических свойств как рассматриваемого i го компонента, так и других компонентов, входящих в систему, а также от следующих режимных параметров: температуры, давления (для газов) и концентрации компонентов.
зависит от физических свойств как рассматриваемого i го компонента, так и других компонентов, входящих в систему, а также от следующих режимных параметров: температуры, давления (для газов) и концентрации компонентов.
Для бинарных смесей (т.е смесей состоящих из 2-х компонентов) в большинстве случаев принимают одинаковые коэффициенты диффузии для обоих компонентов, составляющих систему. В этом случае коэффициент молекулярной диффузии рассматривается как коэффициент взаимной диффузии. Численные значения коэффициентов молекулярной диффузии для газов колеблются от 9·10-6 до 70·10-6 м2/с.
Значения коэффициентов молекулярной диффузии некоторых газов в воздухе при 00С и абсолютном давлении Р = 0,1МПа приведены в таблице 4.1.
Таблица 4.1
Значения коэффициентов молекулярной диффузии некоторых газов
| Газ | D·106 | Газ | D·106 |
| Кислород | 17,8 | Аммиак | 17,0 |
| Азот | 13,2 | Водяной пар | 21,9 |
| Водород | 61,1 | Метиловый спирт | 13,3 |
| Диоксид углерода | 13,8 | Этиловый спирт | 10,2 |
| Диоксид серы | 10,3 | Серный ангидрид | 9,0 |
Если известно значение молекулярной диффузии D1 заданной пары газов при одних значениях Т1 и Р1, то определить коэффициент молекулярной диффузии D2 для тех же газов при других значениях Т2 и Р2 можно по приближенному соотношению
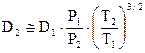 .
.
При низком вакууме (ℓср«ℓ) коэффициент диффузии D пропорционален средней скорости теплового движения и средней длине свободного пути молекулы и определяется по формуле
D = 1,336·10-4·ℓср·Wариф,
где Wариф = 145,51 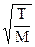 – средняя арифметическая скорость молекул, м/с (здесь
– средняя арифметическая скорость молекул, м/с (здесь 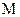 – молекулярная масса газа, кг/кмоль).
– молекулярная масса газа, кг/кмоль).
При высоком вакууме (ℓср»ℓ) коэффициент диффузии D существенно выше. При этом D зависит от скорости теплового движения молекул и размеров вакуумной камеры
D = (dэф.кам.· Wариф)/4,
где dэф.кам – эффективный диаметр камеры, м.
Второй закон Фика
Этот закон устанавливает зависимость между концентрацией, координатами и временем для процесса распространения массы путем молекулярной диффузии. Аналитическое выражение 2-го закона Фика в прямоугольных координатах имеет вид
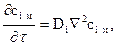
где 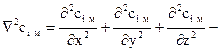 оператор Лапласа.
оператор Лапласа.
Термодиффузия
Явление изменения концентрации, обусловленное наличием неодинаковости температур в различных точках системы называется термодиффузией (эффект Соре).
Количественно рассматриваемое явление для i-го компонента обычно оценивают следующей зависимостью для плотности потока массы кг/(м2·с)
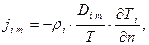 (4.3)
(4.3)
где  – плотность i го компонента (или его массовая концентрация
– плотность i го компонента (или его массовая концентрация 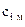 ), кг/м3;
), кг/м3; 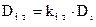 – коэффициент термодиффузии, м2/с (
– коэффициент термодиффузии, м2/с (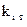 – термодиффузионное отношение).
– термодиффузионное отношение).
Явление термодиффузии учитывают только при больших градиентах температур, так как 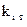 для смесей газов, как правило, меньше 0,1, что приводит к существенному уменьшению
для смесей газов, как правило, меньше 0,1, что приводит к существенному уменьшению 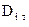 для рассматриваемого
для рассматриваемого 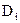 .
.
При наличии в системе градиента концентрации возникает концентрационная диффузия. Поскольку наличие неодинаковых температур вызывает неодинаковость концентрации компонентов, то возникает также градиент концентрации, обусловленный термодиффузией.
Бародиффузия
Перемещение компонентов, обусловленное градиентом давления, вызывают появление градиента концентрации, что обуславливает концентрационную диффузию. При равенстве молекулярных масс компонентов, составляющих систему, бародиффузия отсутствует.
Выражение для плотности i-го потока массы, обусловленного бародиффузией, можно записать в виде
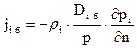 , (4.4)
, (4.4)
где  –плотность i го компонента (или его массовая концентрация
–плотность i го компонента (или его массовая концентрация 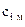 ), кг/м3;
), кг/м3; 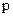 – давление, Па;
– давление, Па; 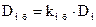 – коэффициент бародиффузии i го компонента, м2/с (здесь
– коэффициент бародиффузии i го компонента, м2/с (здесь 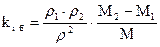 , а
, а 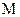 – молекулярная масса).
– молекулярная масса).
 2015-01-07
2015-01-07 4892
4892








