При решении задач этого раздела см. табл. 5 приложения.
При погружении металла в раствор собственной соли часть катионов, расположенных в поверхностном слое, под действием тепловой энергии и поляризующего действия молекул растворителя выходит в раствор. Вышедшие в раствор катионы взаимодействуют с молекулами растворителя - сольватируются (в случае водных растворов - гидратируются).
По мере увеличения концентрации катионов в растворе часть из них под действием электрического поля отрицательно заряженной поверхности будет возвращаться к поверхности и встраиваться в решетку металла. Через определенное время скорости процесса растворения металла и его кристаллизации уравняются. В результате наступит динамическое равновесие.
Большая часть вышедших в раствор катионов будет расположена вблизи поверхности металла. В этом случае силы притяжения катиона к поверхности будут равны силам, способствующим уходу катиона вглубь раствора. Таким образом, образуется двойной электрический слой на границе металл-электролит
Ме(к) + хН2О → Меn+.xH2O(водн) + nē(к).
Обычно при записи уравнения равновесного процесса гидратацию не учитывают
Ме(к) → Меn+(водн) + nē(к).
Скачок потенциала между противоположно заряженными поверхностью металла и раствором называют электродным потенциалом. Абсолютные значения электродных потенциалов измерить не удается. Поэтому обычно определяют относительные электродные потенциалы в определенных условиях, называемые стандартными электродными потенциалами φ0.
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией или активностью, равной 1М, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25оС условно принимается равным нулю (φ0 = 0, ΔG0 = 0).
Зависимость электродного потенциала от природы металла, температуры, концентрации потенциалопределяющих ионов выражается формулой Нернста
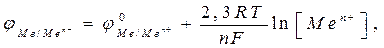
где φ0Ме/Меn+- стандартное значение электродного потенциала; F- число Фарадея; n– величина заряда катиона; R – универсальная газовая постоянная; Т– температура, [Men+] - концентрация соли в растворе.
При Т=2980К 2,3.RT/F= 0,059.
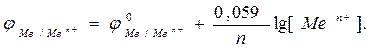
Располагая металлы в ряд по мере возрастания их стандартных потенциалов φ0, получают так называемый “ряд напряжений’’.
Положение металла в ряду напряжений характеризует его восстановительную способность, а также окислительную возможность его иона в водном растворе при стандартных условиях. Чем меньше значение φ0, тем большей восстановительной способностью обладает данный металл в виде простого вещества и тем слабее окислительную способность проявляет его ион и наоборот. Электродный потенциал измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая лежит в основе работы гальванического элемента, протекает в том направлении, в котором ЭДС элемента имеет положительное значение. В этом случае ΔG0 < 0, так как - ΔG0 = nFE0,где Е0 = φ 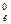 – φ
– φ 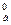 (φ
(φ 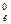 и φ
и φ 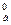 – стандартные потенциалы катода и анода).
– стандартные потенциалы катода и анода).
Пример 1. Стандартный потенциал никеля больше стандартного потенциала кобальта (табл. 5). Изменится ли это соотношение, если измерить потенциал никеля в растворе его соли с концентрацией 0,001М, а кобальта – 0,1М?
 2015-02-24
2015-02-24 334
334








