Выпишем из таблицы 9.1 значения стандартных электродных потенциалов металлов: φ0 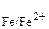 = –0,44 В, φ0
= –0,44 В, φ0 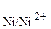 = –0,25 В. Поскольку φ0
= –0,25 В. Поскольку φ0 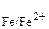 < φ0
< φ0 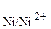 , то железо будет выполнять функцию анода, а никель – катода.
, то железо будет выполнять функцию анода, а никель – катода.
В кислой среде электронные уравнения процессов имеют вид:
– анодная реакция: Fе0 – 2ē = Fе2+;
– катодная реакция: 2Н+ + 2ē = Н02.
Продуктами коррозии являются хлорид железа FeCl 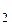 и водород.
и водород.
Во влажном воздухе на катодном и анодном участках происходят следующие реакции:
– анодная реакция: Fе 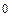 – 2ē = Fе
– 2ē = Fе 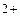 ;
;
– катодная реакция: 2Н 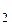 O + O
O + O 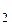 + 4ē = 4OH
+ 4ē = 4OH 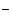 .
.
Продукты коррозии Fе 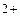 + 2OH
+ 2OH 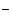 = Fе(OH)
= Fе(OH) 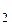 .
.
В присутствии влаги и кислорода происходит дальнейшее окисление железа до трехвалентного состояния:
4Fе(OH) 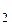 + 2Н
+ 2Н 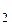 O + O
O + O 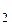 = 4Fе(OH)
= 4Fе(OH) 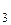 .
.
Для количественной оценки коррозионной стойкости металлов используют массовый (j) и глубинный (П) показатели.
Скорость химической реакции определяется из соотношения:
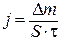 , г/м2.ч (или г/м2.год), , г/м2.ч (или г/м2.год),
| (10.2) |
где ∆ m – изменение массы образца, г;
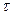 – время коррозии, час или год;
– время коррозии, час или год;
S – площадь поверхности коррозии, м2.
Глубинный показатель коррозии П равен:
П = 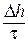 , мм/год, , мм/год,
| (10.3) |
где ∆ h – толщина металла, разрушенного в течение времени t.
Величины П и j связаны соотношением:
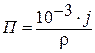 , если j измеряется в г/м2.год,
, если j измеряется в г/м2.год,
или
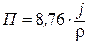 , если j измеряется в г/м2.ч,
, если j измеряется в г/м2.ч,
где r – плотность металла, г /см3.
По вышеприведенным показателям оценивается, как правило, общая коррозия системы.
 2015-02-27
2015-02-27 519
519








