Электронная конфигурация внешнего энергетического уровня атомов элементов III периода аналогична электронной конфигурации атомов элементов II периода. Различие состоит лишь в том, что у элементов III периода заполняются орбитали третьего энергетического уровня (n = 3), который образован одной s-орбиталью, тремя p-орбиталями, пятью d-орбиталями:
элемент второго периода элемент третьего периода
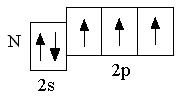
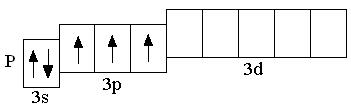
У атомов всех элементов III периода, находящихся в невозбуждённом состоянии, 3d-орбитали являются вакантными (т.е. незаполненными электронами). Невозбуждённое (основное) состояние атома – это такое состояние, в котором каждый электрон занимает орбиталь с минимально возможной энергией. В возбуждённом состоянии электрон занимает орбиталь с более высокой энергией, хотя мог бы находиться на орбитали с более низкой энергией:
невозбуждённое состояние возбуждённое состояние
Анализируя число неспаренных электронов в атоме, можно спрогнозировать его валентность: атом фосфора может быть как трёхвалентным (3 неспаренных электрона в основном состоянии), так и пятивалентным (в возбуждённом состоянии). 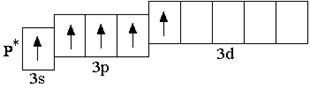
Теоретически, на 9 атомных орбиталях третьего энергетического уровня могли бы разместиться 18 электронов. Но на практике на внешнем энергетическом уровне любого атома не бывает более 8 электронов. Таким образом, все восьмиэлектронные конфигурации ns2np6 являются завершёнными. Несмотря на то, что у атома аргона есть свободные 3d-орбитали, их заполнение происходит только в следующем четвёртом периоде.
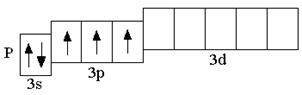 1.6 Элементы IV периода (K–Kr)
1.6 Элементы IV периода (K–Kr)
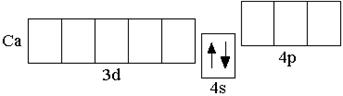
У последнего элемента III периода – аргона – полностью заполнены 3s- и 3p-подуровни, но свободны все 3d-орбитали. Однако, у следующих за аргоном элементов – калия и кальция – заполнение третьего электронного слоя временно прекращается и начинает формироваться s-подуровень внешнего четвёртого энергетического уровня:
K 1s22s22p63s23p63d0 4s1 Ca 1s22s22p63s23p63d0 4s2
Это объясняется тем, что
4s-орбиталь имеет более низкую энергию, чем свободные
3d-орбитали.
 После кальция появляется ряд из десяти d-элементов (Sc–Zn), у которых происходит заполнение 3d-орбиталей. Например, у первого d-элемента IV периода скандия на d-орбиталях находится один электрон,
После кальция появляется ряд из десяти d-элементов (Sc–Zn), у которых происходит заполнение 3d-орбиталей. Например, у первого d-элемента IV периода скандия на d-орбиталях находится один электрон,
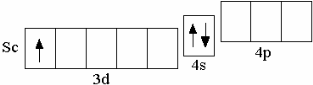
Sc 3d14s2
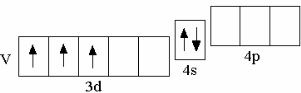 у третьего по счёту d-элемента IV периода – ванадия – на d-орбиталях располагаются 3 электрона,
у третьего по счёту d-элемента IV периода – ванадия – на d-орбиталях располагаются 3 электрона,
V 3d34s2
У последнего (десятого) d-элемента IV периода – цинка – 10 d-электронов:
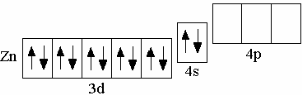
Zn 3d104s2
Следует обратить внимание, что электронная конфигурация атома хрома (четвёртый по счёту d-элемент IV периода) не 3d44s2, а 3d54s1. 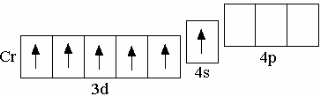 Это объясняется «проскоком» одного электрона с 4s-орбитали на 3d-орбиталь, в результате чего образуется наполовину заполненный 3d-подуровень, обладающий повышенной устойчивостью. Повышенной устойчивостью обладают также полностью заполненные электронами подуровни, вследствие чего «проскок» электрона происходит также у атома меди (медь – девятый d-элемент IV периода, однако его электронная конфигурация не 3d94s2, а 3d104s1). После ряда d-элементов в IV периоде идёт заполнение p-орбиталей у элементов Ga – Kr, электронная конфигурация которых аналогична электронной конфигурации p-элементов B – Ne или Al – Ar.
Это объясняется «проскоком» одного электрона с 4s-орбитали на 3d-орбиталь, в результате чего образуется наполовину заполненный 3d-подуровень, обладающий повышенной устойчивостью. Повышенной устойчивостью обладают также полностью заполненные электронами подуровни, вследствие чего «проскок» электрона происходит также у атома меди (медь – девятый d-элемент IV периода, однако его электронная конфигурация не 3d94s2, а 3d104s1). После ряда d-элементов в IV периоде идёт заполнение p-орбиталей у элементов Ga – Kr, электронная конфигурация которых аналогична электронной конфигурации p-элементов B – Ne или Al – Ar.
 2015-02-04
2015-02-04 4401
4401
