Растворимостью называется способность вещества растворяться в том или ином растворителе. Растворение в воде твёрдого вещества прекращается, когда образуется насыщенный раствор, т.е. когда устанавливается химическое равновесие между осадком и раствором. Таким образом, мерой растворимости вещества является концентрация его насыщенного раствора.
При растворении в воде электролитов, например, солей, оснований, в раствор переходят ионы, и равновесие устанавливается между твёрдым нерастворившимся осадком соли и перешедшими в раствор ионами. Рассмотрим этот процесс применительно к малорастворимым электролитам.
Ca3(PO4)2 (твёрдый) ⇆ 3 Ca2+ (раствор) + 2 PO43– (раствор).
Константа равновесия этого процесса K = C3(Ca2+)·C2(PO43–) называется произведением растворимости (ПР).
Таким образом, ПР(Сa3(PO4)2) = C3(Сa2+)·C2(PO43–). Произведение растворимости есть произведение концентраций ионов труднорастворимого электролита в его насыщенном растворе.
Поскольку ПР представляет собой константу химического равновесия (тема химическое равновесие рассматривалась в методических указаниях по общей химии [2]), то, концентрация каждого иона в выражении ПР возводится в степень, соответствующую стехиометрическому коэффициенту в уравнении процесса диссоциации. ПР – справочная величина (см., например, справочники [3; 4]. Зная ПР, можно рассчитать растворимость любого малорастворимого электролита.
Пример 5.1. ПР фосфата кальция равно 1,0×10–29. Рассчитайте растворимость фосфата кальция в чистой воде (в моль/л). Рассчитайте концентрацию ионов кальция в насыщенном растворе в мг/л.
Сделайте вывод, можно ли воду, контактирующую с фосфатом кальция, использовать в технологических процессах пищевых производств, если известно, что предельно допустимая концентрация (ПДК) ионов кальция в воде на предприятиях пищевой промышленности составляет 100 мг/л.
При контакте природной воды с фосфатом кальция часть Ca3(PO4)2 растворяется и образуется насыщенный раствор.
Пусть растворимость Сa3(PO4)2 равна x моль/л. Следовательно, в насыщенном растворе концентрация ионов Сa2+ будет равна 3x моль/л, а концентрация ионов PO43– – 2x моль/л:
|
|
Ca3(PO4)2 (твёрдый) ⇆ 3 Ca2+(насыщ. раствор) + 2 PO43–(насыщ. раствор)
При подстановке равновесных концентраций ионов кальция и фосфат-ионов в выражение произведения растворимости получится уравнение:
ПР(Сa3(PO4)2) = C3(Сa2+)·C2(PO43–)= (3x)3·(2x)2 = 108x5.
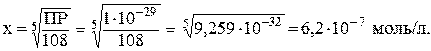 Следовательно,
Следовательно,
Концентрация ионов кальция: C(Ca2+) = 3×x = 3 × 6,2×10–7 = 1,86×10–6 моль/л.
Таким образом, в 1 литре насыщенного раствора Ca3(PO4)2 будет находиться 1,86×10–6 моль ионов Ca2+.
Масса ионов кальция в этом растворе:
m(Ca2+) = n(Ca2+) × M(Ca2+) = 1,86×10–6 моль × 40 г/моль = 7,44×10–4 г = 0,0744 мг.
Таким образом, концентрация ионов Ca2+ в воде, контактирующей с фосфатом кальция, составляет 0,0744 мг/л, что намного меньше допустимой концентрации 100 мг/л, и такую воду можно использовать.
Растворимость часто обозначают буквой s. Как было показано в примере 5.1 s(Сa3(PO4)2) = 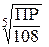 Аналогичным образом можно рассчитать растворимость любого малорастворимого электролита:
Аналогичным образом можно рассчитать растворимость любого малорастворимого электролита:
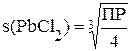
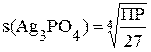
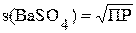
В задании № 6 (таблица 5.1) студентам предлагается рассчитать растворимость малорастворимого электролита в воде и концентрации ионов в образовавшемся насыщенном растворе.
 2015-02-04
2015-02-04 10940
10940
