С образовавшимися аминоацил-тРНК аминокислотные остатки, необходимые для синтеза белка, поступают в рибосомы, где осуществляется синтез пептидных связей. Установлено, что в снабжении рибосом аминокислотами для образования белка тРНК выполняет каталитическую функцию, так как после передачи аминокислоты на рибосому, освободившаяся тРНК может снова соединяться с аминокислотным остатком и может быть использована для нового акта переноса. Скорость оборота тРНК, например, в случае синтеза гемоглобина на рибосоме, составляет 30–40 переносов за 10 минут.
Синтез полипептидной цепи в рибосоме начинается с прикрепления в определённой точке рибосомы N-концевой аминокислоты новообразующегося белка. На I-м этапе прикрепления происходит комплементарное взаимодействие участка полинуклеотидной цепи соответствующей аминоацил-тРНК с участком мРНК, находящейся в рибосоме. Затем предполагается, что N-концевая аминокислота в процессе синтеза белка остается свободной, а закрепление синтезируемой полипептидной цепи на рибосоме осуществляется при посредстве очередной тРНК, приносящей нужную в данный момент аминокислоту.
Процесс биосинтеза белка в рибосоме осуществляется в 3 этапа, так же как и в синтезе нуклеиновых кислот:
I-й этап – инициация происходит при участии 3-х белковых факторов – IF-1, IF-2, IF-3 (факторы инициации), которые являются белками с различной молекулярной массой. Фактор IF-3 вызывает конформационные изменения в малой субъединице рибосомы, способствующие связыванию ею формилметионил-тРНК, которая затем обеспечивает поступление в рибосому первой N-концевой аминокислоты – формилметионина, который открывает полипептидную цепь любого белка, синтезируемого у бактерий. Этот процесс связан с энергетическими затратами за счёт расщепления гуанозинтрифосфата:
ГТФ ® ГДФ + H3PO4
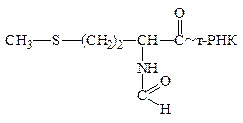
II-й этап – элонгация. Данный этап биосинтеза белка в бактериальной клетке обслуживается тремя белковыми факторами элонгации: EF-TU, EF-TS и EF-G. Процесс элонгации начинается со связывания аминоацил-тРНК, содержащей аминокислотный остаток, который должен быть вторым с N-конца молекулы синтезируемого на рибосоме белка. В пептидильном центре между формилметионил-тРНК и аминоацил-тРНК происходит реакция, благодаря которой остаток формилметионина переносится на свободную аминогруппу аминокислотного остатка, являющегося составной частью аминоацил-тРНК. В результате возникает дипептидил-тРНК, то есть замыкается первая пептидная связь в будущей молекуле белка, а также образуется деацилированная формилметионил-тРНК.
Этот процесс получил название реакции транспептидирования. Он многократно повторяется, пока не закончится полный синтез белковой молекулы.
III-й этап – терминация белкового синтеза в рибосоме осуществляется также при участии трёх белковых факторов – RF-1, RF-2 и RF-3 у бактерий и одного белкового фактора R – у высших организмов. Как только в аминоацильном центре рибосомы займёт соответствующее место терминирующий кодон мРНК, к нему присоединяется один из факторов терминации, чем блокируется возможность присоединения молекулы следующей аминоацил-тРНК. Терминирующим кодонам не соответствует ни один из антикодонов тРНК. Присоединение фактора терминации возбуждает пептидилэстеразную активность рибосомальных белков и они гидролизуют сложноэфирную связь между новообразованным полипептидов и последней тРНК, находящейся в рибосоме. В результате синтезированный белок отделяется от неё, рибосома распадается на субчастицы, поступающий в общий фонд субчастиц клетки. В терминации белкового синтеза и у бактерий, и у млекопитающих принимает участие ГТФ.
 2015-02-14
2015-02-14 2113
2113
