В настоящее время выделены и изучены тРНК, переносящие все постоянно встречающиеся аминокислоты. Установлено, что суммарная масса тРНК составляет около 1% сухой массы клетки и 10–20% массы всей клеточной РНК. В свою очередь лишь только часть суммарной тРНК обладает активностью к переносу аминокислот.
Местом синтеза тРНК в клетке является ядро, из которого она мигрирует в цитоплазму. Характерной особенностью нуклеотидного состава тРНК, по сравнению с другими видами РНК, является ярко выраженный в ряде случаев ГЦ-тип при соотношении пуриновых и пиримидиновых оснований близком к единице. Другой особенностью является присутствие ряда минорных нуклеотидов (6-метиламинопуринового, 2-метиладенинового, 5-метилцитозинового, 1-метилгуанинового), среди которых в большем количестве содержится псевдоуридинфосфорная кислота:
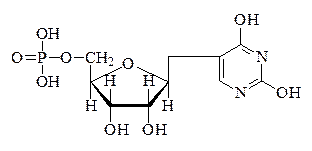
Наличие того или иного числа остатков минорных нуклеотидов связывают со способностью тРНК переносить аминокислоты. Вероятно, что именно минорные нуклеотиды определяют избирательность взаимодействия тРНК с активированными аминокислотными ферментными комплексами. Характерная особенность строения тРНК состоит также в совершенно одинаковом чередовании трёхконцевых нуклеотидов у всех специфических к различным аминокислотам видов тРНК. Концевая триада нуклеотидных остатков представлена всегда одним остатком аденозина и двумя остатками цитидин-нуклеотидов. У многих тРНК полинуклеотидная цепь начинается остатком гуанозина:
Г–[–Аx–Гy–Уz–Цn–]–Ц–Ц–А
Наличие концевой группировки Ц–Ц–А имеет важное значение для функциональной активности тРНК.
По-видимому последовательность нуклеотидных остатков центральной части полинуклеотидной цепи различных тРНК является уникальной в каждом отдельном случае и именно она определяет способность тРНК данного типа избирательно присоединяться к несущему тот или иной аминоациладенилат специфическому активирующему аминокислоты ферменту. Установлено, что аминокислота переносится с аминоациладенилата на концевой остаток аденозина тРНК, присоединяясь по месту водородного атома 2¢- или 3¢-углеродного атома остатка рибозы. Возникающая при этом сложноэфирная связь между аминокислотой и тРНК имеет макроэргический характер:
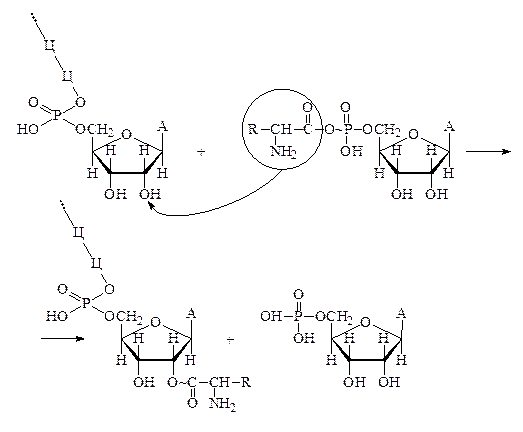
Реакция переноса остатка аминокислоты с аминоациладенилата на тРНК катализируется теми же ферментами (АРС-азами). С образованием аминоацил-тРНК происходит их отделение от фермента и последующая миграция в цитоплазму. Свободные аминоацил-тРНК являются активными соединениями и легко взаимодействуют с нуклеофильными субстратами, содержащими подвижные атомы водорода, в том числе и с аминокислотами по аминогруппе. Прямое участие аминоацил-тРНК в биосинтезе белка установлено различными методами. Наиболее ярко это подтверждается тем, что в системе, где происходит синтез белка, при выключении белкового синтеза накапливаются аминоацил-тРНК. Доказано, что именно аминоацил-тРНК обеспечивают вступление в строго определённую позицию аминокислотного остатка в синтезируемой полинуклеотидной цепи белка (это доказано опытами Шапвиля). В этом опыте цистеинил-тРНК восстановлением была превращена в аланил-тРНК:
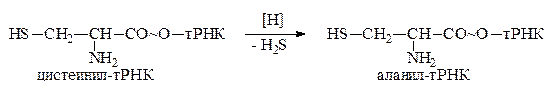
После введения её в белоксинтезирующую систему позиции цистеина в белке оказались занятыми остатками аланина.
 2015-02-14
2015-02-14 1656
1656
