Понятие внутренней энергии тела включает в себя кинетическую энергию движения молекул, кинетическую энергию движения атомов внутри молекул, кинетическую энергию частиц, входящих в состав атомов, потенциальную энергию взаимодействия молекул между собой и атомов внутри молекул. Для идеального газа отсутствует взаимодействие молекул между собой и его внутренняя энергия будет полностью определяться кинетической энергией всех видов движения, в которых может участвовать молекула.
Кинетическая энергия одноатомной молекулы идеального газа определяется выражением:

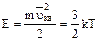 (1)
(1)
где k = 1,38×10 -23 Дж / К - постоянная Больцмана, 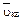 - средняя квадратичная скорость молекулы, m- масса молекулы, T - температура газа.
- средняя квадратичная скорость молекулы, m- масса молекулы, T - температура газа.
По теореме Больцмана при тепловом равновесии для данной температуры Т средняя кинетическая энергия молекул равномерно распределена между степенями свободы молекулы и для каждой степени свободы равна 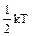 .
.
Под числом степеней свободы подразумевается число независимых координат, которое нужно ввести для полного определения положения тела в пространстве. Положение одноатомной молекулы в декартовой системе координат определяется тремя координатами, т.е. молекула имеет три поступательные степени свободы.
Двухатомную молекулу обычно представляют в форме гантели (жесткая связь), центр которой совпадает с началом координат. Такая молекула может двигаться поступательно как целое в трех взаимно перпендикулярных направлениях. Кроме того, молекула может вращаться вокруг этих же осей, причем вращение вокруг оси, проходящей по линии соединяющей атомы, не изменяет положения системы в пространстве и лишено смысла. Таким образом, для определения положения двухатомной молекулы в пространстве необходимо задать пять степеней свободы (три поступательные и две вращательные). Трехатомная нелинейная молекула, а также любая многоатомная молекула имеет шесть степеней свободы - три поступательных и три вращательных.
Естественно, что жесткой связи между атомами не существует. Поэтому при распределении энергии необходимо учитывать и колебательные степени свободы. Было показано, что двухатомная молекула имеет одну колебательную степень свободы, трехатомная - три, четырехатомная - шесть. Общее число степеней свободы (поступательные, вращательные и колебательные) в n - атомной молекуле равно i = 3n.
Закон распределения энергииимеет место и для вращательных, и колебательных степеней свободы. На каждую вращательную степень свободы также приходится энергия 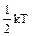 . Если амплитуда колебаний мала по сравнению с расстояниями между атомами, то колебания можно считать гармоническими. На каждую колебательную степень свободы приходится энергия равная kT (
. Если амплитуда колебаний мала по сравнению с расстояниями между атомами, то колебания можно считать гармоническими. На каждую колебательную степень свободы приходится энергия равная kT (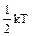 в виде кинетической и
в виде кинетической и 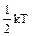 - потенциальной энергии).
- потенциальной энергии).
Следовательно, среднее значение энергии молекулы равно:
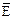 =
= 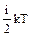 ,
,
где i = i п+ iвр + 2i кол, iп, i вр, i кол - число поступательных, вращательных и колебательных степеней свободы соответственно.
Внутренняя энергия одного моля газа:
Uμ = NA 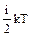 =
= 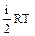 ,
,
где NА - число Авогадро, R = 8,31 Дж/(моль×К) - универсальная газовая постоянная. Таким образом, внутренняя энергия определяется числом степеней свободы и температурой газа и не зависит от его объема.
Изменение внутренней энергии системы может быть осуществлено двумя путями:
1) путем передачи системе (или от системы) некоторого количества теплоты dQ;
2) путем совершения системой работы против внешних сил (или совершения внешними силами работы над системой).
Закон сохранения энергии в этом случае формулируется следующим образом: переданное системе количество теплоты dQ идет на изменение внутренней энергии системы dU и на совершаемую системой работу dA (I закон термодинамики или первое начало термодинамики):
dQ = dU + dA (1)
Теплоемкостью тела C называют величину, равную количеству теплоты dQ, которую нужно сообщить телу (отнять от тела), чтобы изменит его температуруT на 1K:
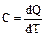
Теплоемкость единицы массы вещества называется удельной теплоемкостью 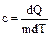 . Ее размерность - [Дж/(кг×К)].
. Ее размерность - [Дж/(кг×К)].
Теплоемкость одного моля вещества называется молярной теплоемкостью С m.= 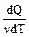 . Ее размерность - [Дж/(моль×К)].
. Ее размерность - [Дж/(моль×К)].
Удельная и молярная теплоемкости связаны соотношением:
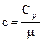 ,
,
где m - молярная масса вещества.
Найдем теплоемкости газа при различных условиях:
1) при постоянном объёме;
2) при постоянном давлении.
1. Изохорный процесс для одного моля вещества(V=const, m=m).
В этом случае работа, совершаемая газом при нагревании:
dA = pdV = 0
и первый закон термодинамики запишется в виде:
dQ =dU,
т.е. все количество теплоты, переданное газу, идет на увеличение его внутренней энергии. Тогда получаем для теплоемкости при V=const:

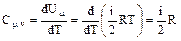 (2)
(2)
2. Изобарный процесс для одного моля вещества(m=m, р=const).
В данном случае количество теплоты, переданное газу, идет на увеличение его внутренней энергии и на совершение им работы против внешних сил:
dQ=dUµ+pdVµ.
Из уравнения состояния следует, что рdV= 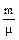 RdT и для одного моля:
RdT и для одного моля:
рdVμ=RdT,
тогда имеем:
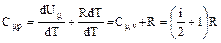 (3)
(3)
 2015-03-07
2015-03-07 547
547








