Пример обработки химического анализа подземных вод, приведенный в табл. 22.
Таблица 22
Результат химического анализа воды
| Сухой остаток, мг/л | рН | Температура, º С | Содержание основных ионов, мг/л | |||||
| НСО3- | SO42- | Cl- | Na+ | Ca2+ | Mg2+ | |||
| 7.6 |
Обработка химического анализа проводится в следующем порядке.
1. Рассчитаем эквивалентное содержание ионов.
Данные анализа пересчитываем из мг/л в мг-экв, используя пересчетные коэффициенты в табл. 14. Например, содержание в воде гидрокарбонат-иона равно
930∙0,0164 = 15,25 мг-экв.
2. Выражаем химический состав воды в %-экв форме, приняв суммы анионов и катионов за 100 % каждую и записываем полученные данные в табл. 23.
Таблица 23
| Анионы | Содержание | Катионы | Содержание | ||||
| мг/л | мг-экв | %-экв | мг/л | мг-экв | %-экв | ||
| НСО3- | 15,25 | Na+ | 4,05 | ||||
| SO42- | 1,58 | Ca2+ | 9,68 | ||||
| Cl- | 0,68 | Mg2+ | 3,70 | ||||
| Итого | 17,51 | Итого | 17,43 |
3. Напишем формулу Курлова и название воды.
M1.0 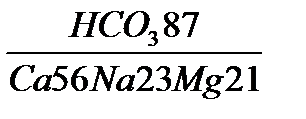 рН 7,6 tº 12
рН 7,6 tº 12
По этой записи воду можно назвать пресной (табл. 16), гидрокарбонатной магниево-натриево-кальциевой, слабощелочной (табл. 17), холодной (табл. 18).
4. Вычисляем виды жесткости и оценим степень жесткости.
Общую жесткость определяем как сумму катионов кальция и магния, выраженных в мг-экв/л:
9,68+3,70=13,38 (мг-экв/л).
По этому показателю – вода очень жесткая (табл. 19). Карбонатная жесткость определяется по содержанию гидрокарбонат-иона. В нашем случае НСО3- =15,25 мг-экв/л > Са2++Мg2+=13,38 мг-экв/л, карбонатная жесткость равна общей, а некарбонатная (остаточная) жесткость отсутствует.
5. Определяем соответствие химического анализа воды техническим условиям (табл. 20).
 2015-03-20
2015-03-20 2411
2411
