По определению Аррениуса (1884 г.), кислота – это соединение, образующее при диссоциации в водном растворе ионы водорода Н+; основание – это соединение, образующее при диссоциации в водном растворе гидроксид–ионы ОН–. К недостаткам определения Аррениуса следует отнести ограниченность понятия кислоты, поскольку это понятие применимо только для водных растворов и не рассматривает реакции, протекающие в органических растворителях и в газовой фазе.
Согласно общей (протонной) теории кислот и оснований Бренстеда (1923 г.), кислота – это вещество, способное отдавать протон, например, HCl, H3O, CH3COOH, NH4+, H2O и др. Под основанием понимают вещества, способные принимать протон: OH-, NH3, CH3COO-, H2O и др. Кислота и основания, связанные уравнением
HA = H+ + A-,
называются сопряжёнными.
Протон в растворах обычно связывается с молекулами растворителя, например в воде:
H+ + H2O→ H3O+.
Если молекулы растворителя не способны ни присоединять, ни отдавать протоны, то растворённое вещество не может проявить кислотно-основных свойств. Такой растворитель называется апротонным. Вещество, способное и отдавать и принимать протоны, называется амфипротонным, например, вода.
Существуют вещества, не содержащие водорода (SnCl4, BF3, AlCl3, ZnCl2 и др.), но кислотные свойства их хорошо известны.
Поэтому Льюис (1938 г.) предложил кислотой называть любое вещество, способное использовать свободную пару электронов другой молекулы для образования устойчивой электронной конфигурации другого атома.
На примере реакции
SO3 + H2O 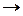 H2SO4
H2SO4
Видно, что H2O является основанием, так как обладает свободной парой электронов, а SO3 – кислотой, поскольку использует эту пару электронов. Кислотами Льюиса являются такие соединения, как FeCl3, AlCl3, BF3; основаниями – NH3,N2H4, NO3–, C6H6, C6H5N.
Льюисовские кислоты и основания могут и не содержать протонов, это акцепторы или доноры электронов соответственно.
По Усановичу (1939 г.), кислота – это вещество, способное отдавать катионы, соединяющиеся с анионами или электронами, или нейтрализующее основание с образованием соли. Основание – это вещество, способное отдавать анионы или электроны, соединяющиеся с катионами, или нейтрализующее кислоты с образованием соли.
В кислотно-основном катализе различают следующие типы реакций.
1) Специфический кислотный и основной катализ.
К первым относятся реакции, в которых активация субстрата осуществляется только ионами водорода, ко вторым – только ионами гидроксила. Простейшие механизмы этих реакций включают обратимое взаимодействие субстрата (S) с каталитической частицей и превращение образующегося комплекса в продукт:
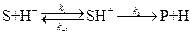 специфический кислотный катализ
специфический кислотный катализ
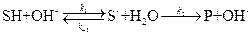 специфический основной катализ
специфический основной катализ
2) Общий кислотный и основной катализ – реакции с активацией субстрата любым донором протонов, кроме ионов водорода, т.е. под действием обобщённых кислот Бренстеда; и реакции с активацией любым акцептором протонов, кроме OH-, т.е. обобщённым основанием Бренстеда соответственно.
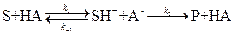 общий кислотный катализ
общий кислотный катализ
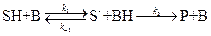 общий основной катализ
общий основной катализ
Для реакций общего кислотного или основного катализа с одним и тем же субстратом известны корреляционные соотношения Бренстеда между константами скорости каталитических реакций и константами кислотности (Ка) или основности (Кb) катализатора:
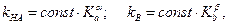 (5.22)
(5.22)
где 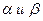 – константы, не превышающие единицы.
– константы, не превышающие единицы.
3) Электрофильный и нуклеофильный катализ – это реакции, в которых катализатором является соответственно кислота или основание Льюиса.
4) Общий кислотно-основной катализ – в каталитической реакции одновременно участвуют Бренстедовские кислота и основание.
5) Электрофильно-нуклеофильный катализ – в реакции участвуют одновременно кислота и основание Льюиса.
 2015-04-01
2015-04-01 8505
8505
