Учебные вопросы
3.1Ртуть
3.2Кадмий
3.3Свинец
3.4Мышьяк
3.5Медь, цинк, железо
3.6Стронций, сурьма, никель, хром и алюминий
3.7Технология переработки пищевого сырья с повышенным содержанием тяжелых металлов
По воздействию на организм человека металлы классифицируют следующим образом:
1) металлы, необходимые в питании человека и животных (Со, Си, Cr, Се, F, Fe, I, Mn, Mo, Ni, Se, Si, V, Zn);
2) металлы, имеющие токсикологическое значение (As, Be, Cd, Си, Со, Cr, F, Hg, Mn, Mo, Ni, Pb, Pd, Se, Sn, Ti, V, Zn).
При этом следует отметить, что 10 из перечисленных элементов отнесены к обеим группам оказывают вредного действия и не несут биологических функций, однако в высоких дозах оказывают токсическое действие.
Таким образом, не всегда возможно установить различие между жизненно необходимыми и токсичными металлами. Все металлы могут проявить токсичность, если они потребляются в избыточном количестве. Кроме того, токсичность металлов проявляется в их взаимодействии друг с другом. Например, физиологическое воздействие кадмия на организм, в том числе его токсичность, зависят от количества присутствующего цинка, селена, а функции железа в летках определяются присутствием меди, кобальта и в некоторой степени молибдена и цинка. Тем не менее существуют металлы, которые проявляют сильно выраженные токсикологические свойства при самых низких концентрациях и не выполняют какойлибо полезной функции. К таким токсичным металлам относят ртуть, кадмий, свинец, мышьяк. Они не являются ни жизненно необходимыми, ни благотворными, но даже в малых дозах приводят к нарушению нормальных метаболических функций организма.
Ртуть, кадмий, свинец, мышьяк, медь, стронций, цинк, железо объединенная комиссия ФАО/ВОЗ по пищевому кодексу (Codex алimentarilis) включила в число компонентов, содержание которых контролируется при международной торговле продуктов питания. В России и СНГ подлежат контролю еще 6 элементов (сурьма, никель, хром, алюминий, фтор, йод), а при наличии показаний могут контролироваться и некоторые другие металлы. Медикобиологическими требованиями СанПиН 2.3.2. 56096 определены критерии безопасности для следующих металлов: свинец, кадмий, ртуть, медь, цинк, олово, железо.
Ртуть
Ртуть сравнительно легко извлекается из руд и, несмотря на относительно ограниченное практическое применение, широко известна в течение многих веков. Ртуть своеобразный металл, в нормальных условиях это жидкость. Именно изза этого ртуть бы названа «жидким серебром».
В эпоху Ренессанса ртуть в основном ценилась своими медицинскими свойствами, а также использовалась в смеси с другими металлами как средство серебрения зеркал. Для средневековых алхимиков ртуть имела особую ценность и играла важную роль в поисках философского камня — таинственного вещества, которое превращает простые металлы в золото. Только в последнее столетие доказано, что ртуть участвует во многих химических реакциях как катализатор.
Благодаря своим свойствам она находит широкое применение в промышленности. Ежегодно в мире получают более 10 тыс. т ртути. Из них примерно 25% используют для производства электродов при получении хлора и щелочей, 20% — в электрическом оборудовании, 15% при производстве красок, 10% для производства ртутных приборов, таких, как термометры, 5% в производстве зеркал, в агрохимии и 3% в качестве ртутной амальгамы при лечении зубов. Еще около 25% производимой ртути используется в других отраслях промышленности: при получении детонаторов, катализаторов (например, для производства ацетальдегида и поливинилхлорида), в производстве бумажной пульпы, фармацевтике и косметике, а также в военных целях. Промышленное значение имеют высокотоксичные неорганические соединения ртути, в частности сулема, из которой получают другие ртутные соединения и которая применяется при травлении стали.Сулема вызывает смертельные отравления при приеме внутрь в количестве 0,2...0,3 г. Органические соединения ртути применяли в качестве фунгицидов при обработке зерна. Однако с тех пор, как стало известно об опасности подобных соединений, во многих странах их использование было запрещено.
Подсчитано, что кроме 10 тыс. т ртути, добываемых в мире при горнорудных разработках, еще 10 тыс. т металла выделяется в окружающую среду при сгорании угля, нефти и газа, добыче пустой породы и других индустриальных разработках. Естественным образом ежегодно от 30 до 50 тыс. т ртути выделяется при дегазации земной коры и океанов.
Ртуть относится к числу рассеянных в природе микроэлементов. По распространению в земной коре она занимает 62е место, средняя концентрация составляет 0,5 мг/кг. В природе ртуть находится в 3 окисленных состояниях: металлическая, или атомарная, (Hg°), окисленная со степенью окисления +1 (Hg+) и окисленная со степенью окисления +2 (Hg2+).
В пищевых продуктах ртуть может присутствовать в 3 видах: атомарная ртуть, окисленная ртуть Hg2+ и алкилртуть — соединения ртути с алкилируюшими соединениями.
Случаи загрязнения пищевых продуктов металлической ртутью являются очень редкими.
Ртуть плохо адсорбируется на продуктах и легко удаляется с поверхности пищи.
С токсикологической точки зрения ртуть наиболее опасна, когда она присоединена к углеродному атому метиловой, этиловой или пропиловой группы это алкильные соединения с короткой цепью.
Процесс метилирования ртути является ключевым звеном в ее биокумуляции по пищевым цепям водных экосистем: как ионы метилртути, так и диметилртуть сорбируются организмом. Если в основных пищевых продуктах содержание ртути менее 60 мкг на 1 кг продукта, то в пресноводной рыбе из незагрязненных рек и водохранилищ это содержание составляет от 100 до 200 мкг/кг массы тела, а из загрязненных 500...700 мкг/кг. Среднее количество ртути в морских рыбах составляет 150 мкг на 1 кг их массы.
Ртуть аккумулируют планктонные организмы (например, водоросли), которыми питаются ракообразные. Ракообразных поедают рыбы, а рыб птицы.
Концевыми звеньями пищевых цепей нередко бывают чайки и орланы. Человек может включаться на любом этапе и, в свою очередь, тоже становиться концевым звеном; большей частью это происходит в результате потребления рыбы. За естественное содержание ртути в рыбах принимают величину 0,1...0,2 мг/кг. ВОЗ предложила считать предельно допустимой концентрацией 0,5 мг/кг. В водной пищевой цепи концентрация метилртути от звена к звену увеличивается, так как метилртуть растворима в жирах, она легко переходит из воды в живые организмы.
Токсическая опасность ртути выражается во взаимодействии с SHгруппами белков. Блокируя их, ртуть изменяет биологические свойства тканевых белков и инактивирует ряд гидролитических и окислительных ферментов. Ртуть, проникнув в клетку, может включиться в структуру ДНК, что сказывается на наследственности человека. Мозг проявляет особое сродство к метилртути и способен аккумулировать почти в 6 раз больше ртути, чем остальные органы.
Метилртуть выводится из организма частично через почки, а в основном через печень и желчь, а далее с фекалиями. Продолжительность выведения соединений ртути из организма полупериод биологического их распада составляет около 70 дней, однако процесс выведения ртути зависит от особенностей организма каждого человека. У 10% населения период полураспада в организме был свыше 190 дней.
Даже растительные продукты могут быть источником ртути, если к компосту добавить средство для улучшения структуры почвы, содержащее ртуть.
Таким образом, определение ртути в пищевых продуктах и других биологических объектах требует особого внимания и точности для исключения ртутного отравления организма.
Допустимое недельное поступление ртути не должно превышать 0,3 мг на человека, в том числе метилртути не более 0,2 мг, что эквивалентно 0,005 мг/кг и 0,0033 мг/кг массы тела за неделю.
Далее приведены дифференцированные нормы ПДК ртути(мг/кг продукта) в соответствии с СанПиН 2.3.2. 56096
- Напитки, питьевая вода, молоко, сливки, сметана, кисломолочные продукты, продукты детского питания0,005;
- Сахар и сахаристые кондитерские изделия0.01;
- Молочные консервы, хлеб и хлебобулочные изделия 0.015;
- Мучные кондитерские изделия, овощи и плоды, консервы овощные и фруктовые, яйца и яйце продукты, творог0.02;
- Рыба и рыбные продукты, рыбий жир0.3;
- Икра рыб и продукты из них, моллюски и ракообразные0.2;
- Соль поваренная, субпродукты, шоколад и шоколадные изделия0.1;
- Грибы, маргарины, кулинарные жиры, майонезы, желатин 0.05;
- Мясо и мясопродукты, колбасные изделия 0,035.
Кадмий
Кадмий представляет собой один из самых опасных токсикантов внешней среды. В природной среде кадмий встречается в очень малых количествах, именно поэтому его отравляющее действие было выявлено лишь недавно. В последние 30...40 лет он все больше применяется в промышленности. Кадмий содержится в мазуте и дизельном топливе, освобождаясь при их сгорании; используется он в качестве присадки к сплавам, при нанесении гальванических покрытий (кадмирование неблагородных металлов), для получения кадмиевых пигментов, необходимых для производства лаков, эмалей и керамики, в качестве стабилизатора пластмасс (например, поли винилхлорида), в электрических батареях. В результате всего этого, а также при сжигании кадмийсодержащих пластмассовых отходов кадмий может попадать в воздух. Кадмий также обычно сопутствует в природных рудах другим металлам, чаще всего цинку. Соотношение кадмия и цинка в минералах и почвах варьирует от 1:100 до 1:1000.
Кадмий опасен в любой форме принятая внутрь доза 30...40 мг уже может оказаться смертельной. Поэтому даже потребление напитков из пластмассовой тары, материал которой содержит кадмий, является чрезвычайно опасным. Поглощенное количество кадмия выводится из организма очень медленно (0,1% в сутки), легко может происходить хроническое отравление. Для кадмия период полувыведения составляет более 10 лет, поэтому даже следам кадмия, если они систематически попадают в организм, надо уделять самое серьезное внимание. Ранние симптомы отравления поражение почек и нервной системы с последующим возникновением острых костных болей. Типично также нарушение функции легких. В организме кадмий в первую очередь накапливается в почках, и после достижения пороговой концентрации около 0,2 мг кадмия на 1 г массы почек появляются симптомы тяжелого отравления и почти неизлечимого заболевания.
Кадмий почти невозможно изъять из природной среды, поэтому он все больше накапливается в ней и попадает различными путями в пищевые цепи человека и животных. Больше всего кадмия мы получаем с растительной пищей. Кадмий легко переходит из почвы в растения, последние поглощают до 70% кадмия из почвы и лишь 30% из воздуха
Эксперты ФАО полагают, что взрослый человек с рационом получает 30... 150 мкг кадмия в сутки, причем в Европе 30...60 мкг, в Японии 30... 100 мкг, в кадмиевых геохимических районах около 300 мкг.
Количество кадмия, попадающее в организм человека, зависит не только от потребления им кадмийсодержащих пищевых продуктов, но и в большой степени от качества его диеты. В частности, железо может заметно изменить аккумуляцию кадмия. Достаточное количество железа в крови, повидимому, тормозит аккумуляцию кадмия. Кроме того, большие дозы витамина D действуют как противоядие при отравлении кадмием.
Всемирная организация здравоохранения считает максимально допустимой величину поступления кадмия для взрослых людей 500 мкг в неделю, то есть ДСП 70 мкг/сут, а ДСД 1 мкг/кг массы тела.
Далее приведены дифференцированные нормы ПДК кадмия (мг/кг продукта) в соответствии с СанПиН 2.3.2. 56096 ПДК в основных пищевых продуктах:
- Почки, икра и продукты из нее 1.0;
- Печень рыб и продукты из нее 0,7;
- Шоколад и шоколадные изделия 0,5;
- Субпродукты0,3;
- Сыры,рыба и рыбные продукты 0,2;
- Творог н творожные изделия, молочные консервы, зерно, крупа, мука, сахарные и мучные кондитерские изделия, поваренная соль0,1;
- Яйца и яйцепродукты, питьевая вода0,01;
- Молоко и кисломолочные продукты, овощи и фрукты, 0,03;
- консервы овощные и фруктовые, напитки, масло сливочное, продукты детского питания 0,05;
- Мясо и мясопродукты, сахар, масло растительное, маргарины 0,07;
- Хлеб, булочные и сдобные изделия 0,05.
Свинец
Свинец относится к наиболее известным ядам и среди современных токсикантов играет весьма заметную роль.
Действительно, об опасности, связанной с использованием металла и свинцовых изделий человечеству было известно, по крайней мере, 2000лет назад. Во времена расцвета Древнего Рима были введены в употребление свинцовые трубы для водопроводов и металлические сплавы, содержащие свинец, для кухонной посуды и сосудов для питья. Можно с уверенностью полагать, что в этот период у представителей высших слоев римского общества в организме накапливались повышенные количества свинца. Исследование содержания свинца в скелетах из захоронений того времени подтверждает это предположение. На этих данных базируются теории, объясняющие упадок римского могущества хроническим свинцовым отравлением тогдашней интеллигенции. Отравления, которые наблюдали в Древней Греции у работавших со свинцом людей, получили название сатурнизма или плюмбизма. Симптомами отравлений являлись колики, сопровождавшиеся бредовым состоянием и параличами. Это отметил еще Гиппократ в 400 г. до н.э., наблюдая за людьми, работавшими со свинцом. Свинец находится в микроколичествах почти повсеместно. В почвах обычно содержится от 2 до 200 мг/кг свинца. Свинец, как правило, сопутствует другим металлам, чаще всего цинку, железу, кадмию и серебру. Большие залежи свинецсодержащих руд встречаются во многих частях света.
Главными государствами, обладающими запасами свинцовых руд, являются США, Россия, Австралия, Канада, Перу, Мексика, Китай, Болгария. Мировое производство свинца в 2000 г. составляет, по оценкам, 6 млн т. Широкое использование свинца человеком объясняется легкостью его выделения из руд.
Свинец используют в виде металла и в виде его химических соединений. Наибольшая доля добываемого свинца используется на изготовление свинцовых аккумуляторов для автомобилей, электротранспорта и других целей. Свинец применяют также для покрытия кабелей. Ежегодно в Великобритании для этих целей используется около 60 тыс. т свинца. Его традиционно используют для изготовления пуль и снарядов, для пайки швов жестяных банок, в полиграфии. Оксид свинца применяют для изготовления белил, свинцового сурика, глазурования керамических изделий. Соли свинца широко используются в производстве стеклянных изделий, для изготовления высококачественного хрусталя, телевизионных трубок и флуоресцентных ламп.
В наше время в роли токсикантов окружающей среды выступают прежде всего алкильные соединения свинца, такие, как тетраэтил свинец, которые добавляют к автобензину в качестве антидетонаторов. Только в Германии в 1989 г. грузовыми автомобилями было выброшено в воздух 7 тыс. т свинца. В Балтийское море ежегодно поступает 5400 т свинца, причем 75% этого количества попадает из воздуха. Заметное повышение содержания свинца выявлено даже во льдах Гренландии.
Загрязнение окружающей среды происходит также при выплавке свинца и при сбросе вод из рудников. Пестициды, содержащие свинец, могут непосредственно увеличить содержание свинца во фруктах и овощах, а при достаточно длительном использовании таких пестицидов свинец поступает в продукты непосредственно из загрязненной почвы.
При обработке продуктов основным источником поступления свинца является жестяная банка, которая используется для упаковки от 10 до 15% пищевых изделий. Свинец попадает в продукт из свинцового припоя в швах банки В последнее время с внедрением новых методов пайки и закатки банок содержание свинца в консервированной продукции уменьшается.
Около 10% поглощенного с пищей, питьем и из воздуха свинца абсорбируется в желудочнокишечном тракте. На степень абсорбции могут влиять различные факторы. Например, снижение содержания кальция приводит к усилению абсорбции свинца. Витамин D увеличивает поглощение как кальция, так и свинца. Недостаток железа также способствует абсорбции свинца, что наблюдается при голодании. К такому же эффекту приводит диета с повышенным содержанием углеводов, но дефицитом белков.
После попадания в кровеносную систему свинец разносится по всему телу, включаясь в клетки крови и плазму. Установлено, что полупериод биологического распада время, необходимое для снижения вдвое от исходного содержания накопившегося в органе или в организме металла, для свинца составляет в организме в целом 5 лет, в костях человека 10 лет.
Свинец токсически воздействует на 4 системы органов: кроветворную, нервную, желудочнокишечную и почечную. Поражение периферической нервной системы выражается в так называемых «свинцовых параличах», приводящих к параличу мышц рук и ног.
Экспертами ФАО и ВОЗ усыновлена величина максимально допустимого поступления свинца для взрослого человека 3 мг в неделю,то есть ДСД составляет около 0,007 мг/кг массы тела, а ПДК в питьевой воде 0,05 мг/л. ПДК свинца в основных пищевых продуктах в соответствии с требованиями СанПиН 2.3.2. 56096 приведена на рис. 1
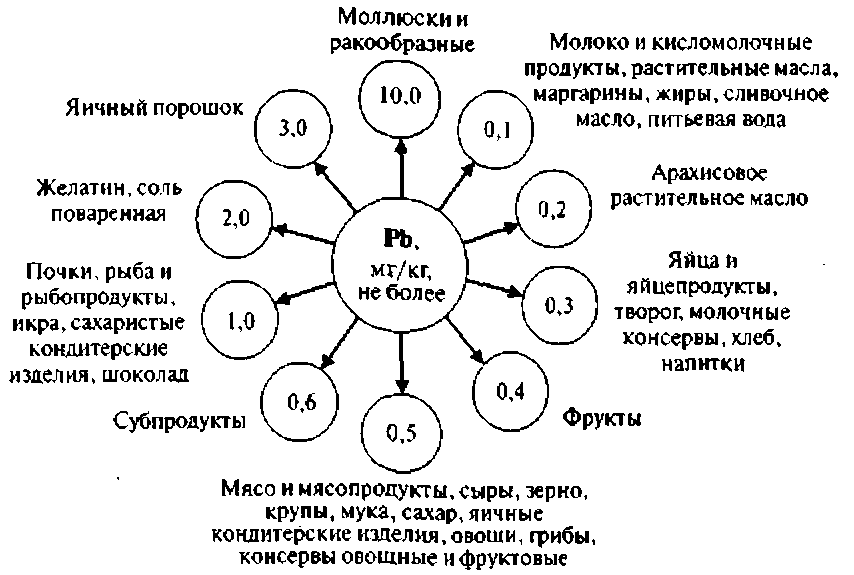
Рисунок 1 ПДК свинца в основных пищевых продуктах
Мышьяк
Мышьяк широко распространен в окружающей среде. Он встречается почти во всех почвах. Наиболее распространенными неорганическими соединениями мышьяка являются оксид трехвалентного мышьяка (Ш) As203 и оксид пятивалентного мышьяка (V) As205. Другими важными соединениями мышьяка являются хлорид мышьяка (Ш) и различные соли, такие, как арсенат свинца, а также газообразное водородное соединение арсин (AsH,).
Для мышьяка, так же как и для ртути, характерна реакция метилирования. В природе наблюдается переход арсенатов в арсениты, а затем при их метилировании происходит образование метил мышьяковой и диметилмышьяковистой кислот.
Мировое производство мышьяка составляет приблизительно 50 тыс. т в год. В последнее время производство мышьяка каждые 10 лет возрастает на 25%.
Мышьяк применяется в металлургии при получении некоторых сплавов для увеличения твердости и термостойкости сталей.
В химической промышленности мышьяк используется в производстве красящих веществ, а также стекла и эмалей.
В результате широкого распространения в окружающей среде и использования в сельском хозяйстве мышьяк присутствует в большинстве пищевых продуктов. Обычно его содержание в пищевых продуктах достаточно мало менее 0,5 мг/кг и редко превышает 1 мг/кг, за исключением некоторых морских организмов, которые аккумулируют этот элемент.
Мышьяк присутствует почти во всех пресных водах. Однако в питьевой воде из различных источников уровни содержания мышьяка определяются природой залегающих пород.
Промышленные, а также случайные загрязнения могут привести к значительному увеличению естественного уровня мышьяка в пищевых продуктах и напитках.
Использование соединений мышьяка в составе пестицидов для обработки виноградников привело к случаям отравления винами.
Механизм токсического действия мышьяка заключается в связывании им сульфгидрильных групп белков и ингибировании действия многих ферментов, участвующих в процессах клеточного метаболизма и дыхания.
Хроническое отравление мышьяком приводит к потере аппетита и снижению массы, гастрокишечным расстройствам, периферийным неврозам, конъюнктивиту, гиперкератозу и меланоме кожи. Меланома возникает при длительном воздействии мышьяка и может привести к развитию рака кожи.
Поданным экспертов ФАО/ВОЗ, в организм взрослого человека поступает в среднем 0,005...0,42 мг мышьяка в сутки, то есть около 0,007 мг/кг массы тела, и может достигать I мг в зависимости от его содержания в рационе питания и окружающей среде.
Экспертами ФАО и ВОЗ установлена ДСД мышьяка 0,05 мг/кг массы тела, что для взрослого человека составляет около 3 мг/сут. ПДК мышьяка в соответствии с требованиями СанПиН 2.3.2. 56096 приведена на рисунке 2
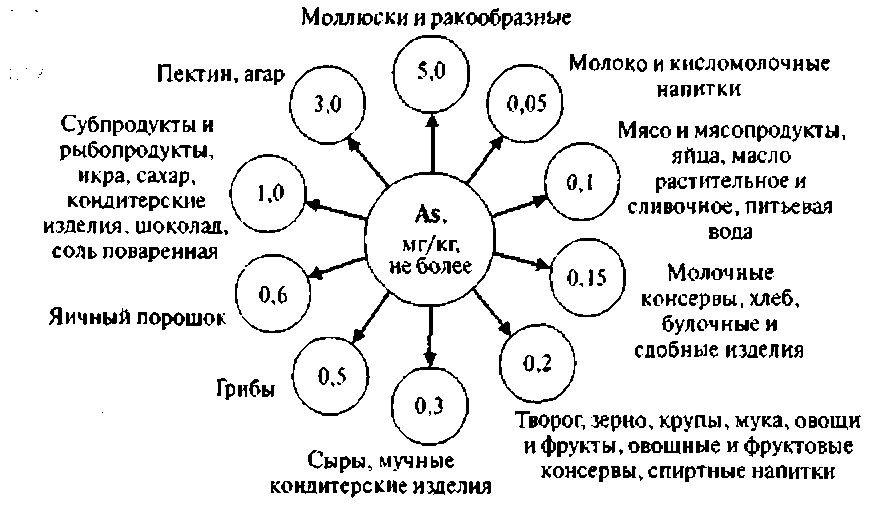
Рисунок 2 ПДК мышьяка в основных пищевых продуктах
 2015-04-30
2015-04-30 9062
9062
