ИЗМЕРЕНИЕ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ МЕТАЛЛОВ И ПОКРЫТИЙ.
Цель работы
Измерение электродных потенциалов металлов и покрытий в растворах собственных ионов и в различных коррозионноактивных средах. Определение коррозионной стойкости исследуемых материалов, прогнозирование коррозионного поведения по электрохимическим характеристикам по стандартам ГОСТ 6032-75, NACE, ISO.
Введение
При погружении металла в электролит в результате взаимодействия поверхности металла с раствором возникает разность электрических потенциалов, которую называют электродным потенциалом. Если во взаимодействии металла и электролита участвуют только ионы металла, то протекают следующие процессы:
1) переход ионов из металла в раствор с образованием гидратированных ионов (анодный процесс):
Me + nН2О = Ме n+ · nН2О + ne (1)
2) разряд ионов из раствора на поверхности металла (катодный процесс):
Меn+ • nН2О + nе = Me + nН2О. (2)
При достижении равновесия (равенство скоростей анодного и катодного процессов) устанавливается постоянное значение потенциала металла.
Потенциалы металлов, находящихся в равновесии с собственными ионами в растворе, называются обратимыми или равновесными и подчиняются уравнению Нернста:
Е Me = Е° Me + 2,303(RT lg а Me )/nF, (3)
где ЕМе — обратимый электродный потенциал металла, В,
Е ° Me — стандартный потенциал: потенциал металла при активности его ионов в растворе, равной единице;
R —8,314 джоуль/(град ×моль), газовая постоянная
Т — абсолютная температура, °К;
n — валентность ионов, переходящих в раствор;
F = 96493 Kл/моль—постоянная Фарадея;
а – активность ионов металла в растворе;
а=с×f (4),
где с— концентрация ионов металла в растворе, г-ион на 1000 г растворителя;
f- коэффициент активности ионов в растворе, мера отклонения реального раствора от идеального состояния.
Таким образом, активность выражает собой действующую или эффективную концентрацию ионов в растворе. Однако в разбавленных растворах (в случае коррозии металла в растворе или при бесконечном разведении) коэффициент активности принимают равным 1, при этом активность ионов металла становится равной их концентрации в растворе.
Абсолютный электродный потенциал представляет собой разность потенциалов точек, лежащих в двух разных фазах – металле и растворе.
В настоящее время не существует методов экспериментального определения абсолютных значений электродных потенциалов. Поэтому измеряют разность потенциалов для точек, лежащих в пределах одной фазы. На практике электродным потенциалом называют электродвижущую силу элемента, составленного из данного электрода и водородного электрода в нормальных условиях, то есть при активности ионов водорода равной 1
(a H+ =1) и парциальном давлении в 1 атм (pH2=1).
Me|Men+, H2O || H+(aН+ = 1), H2O |(H2) Pt (pH2 =1)
Потенциал водородного электрода при всех температурах условно принят равным нулю. Часто при измерении электродных потенциалов металлов вместо водородного электрода применяют хлоридсеребряный электрод, а затем пересчитывают полученные значения на водородную шкалу. При этом электрохимическая система имеет следующий вид:
Me½Men+ H2O || КCl, AgCl | Ag
Если потенциал электрода определяют относительно потенциала водородного электрода, то вводят обозначение (Н.В.Э), если относительно хлоридсеребряного – то (Х.С.Л.)
Потенциалы электродов, у которых в процессе взаимодействия металла и электролита участвуют не только собственные, но и другие ионы и атомы, являются необратимыми или неравновесными электродными потенциалами. Они не подчиняются термодинамическому уравнению (3), следовательно, их рассчитать по уравнению Нернста, а можно определить только опытным путем.
Устойчивое значение необратимого потенциала, наступающее при равенстве сумм скоростей анодных и катодных процессов, называется стационарным необратимым потенциалом. Величина стационарных необратимых потенциалов металлов зависит от природы металла, природы и концентрации электролита и от физических условий (температуры, давления и других факторов). Этот потенциал является потенциалом коррозии Екор.
Для решения вопроса, является ли потенциал металла в данном растворе обратимым или необратимым, следует сопоставить теоретическое, рассчитанное по уравнению (3), и опытное значения потенциала и сравнить зависимость потенциала металла от активности (концентрации) собственных ионов в растворе, полученную теоретически и опытным путем.
Если потенциал металла является неравновесным, то сопоставляя его значение с равновесными потенциалами растворяющегося металла и восстанавливающегося окислителя E0 м / м и E0 Оx/ Red можно сделать вывод о том, к какому из этих потенциалов приближается Eкор. Величина потенциала коррозии не позволяет непосредственно сделать заключение о скорости коррозии, но можно, сопоставляя значение Екор, EМе+/Ме, Е Оx/ Red с рассчитанными величинами E0 Ме+ /Ме и E0 Оx/ Red
- оценить термодинамическую вероятность коррозионного процесса,
DG = -nF (E Оx/ Red - E Ме+ /Ме )
- установить, за счёт какой катодной реакции протекает коррозионный процесс,
- определить его движущую силу:
D Е = (E Оx/ Red - E Ме+ /Ме )
- определить соотношение анодного (hа) и катодного (hк) перенапряжения:
hа = Екор - E Ме+ /Ме ;
hк = Екор - Е Оx/ Red;
- выявить наиболее замедленную стадию коррозионного процесса, так называемый контролирующий фактор коррозии, для определения которого рассчитывают степень контроля общего процесса коррозии анодной и катодной стадиями
степень анодного (С А) контроля:
С А = hа * 100 / (E Оx/ Red - E Ме+ /Ме ) %,
степень катодного (СК ) контроля:
СК = hк * 100 / (E Оx/ Red - E Ме+ /Ме )%.
Определение этих параметров процесса коррозии имеет большое практическое значение, поскольку разработка многих методов защиты металлов от коррозии основана на устранении термодинамической вероятности процесса коррозии, а также на увеличении степени торможения одной или нескольких стадий процесса.
Экспериментально доказано, что потенциалы ряда металлов (Ag, Cu, Cd и др.) в широком диапазоне концентраций собственных ионов соответствует обратимым или равновесным значениям потенциалов, однако при очень низких концентрациях собственных ионов значения потенциалов перестают удовлетворять уравнению (3). Это объясняется участием в катодном процессе водородного иона:
Н+ • Н2О + е ® 1/2 H2 + Н2О (5)
или растворенного кислорода воздуха:
О2 + 2Н2О + 4е ® 4ОН- , (6)
что приводит к нарушению равновесия и растворению металла.
При повышении концентрации ионов металла за счет его растворения катодный процесс опять может осуществляться в основном ионами металла, и значение потенциала будет подчиняться уравнению Нернста (3).
В условиях эксплуатации металл обычно находится в растворе чужеродных ионов. Для выявления природы электродного потенциала металла при его погружении в раствор чужеродных ионов нужно знать активность собственных ионов металла в электролите. При образовании растворимых продуктов коррозии концентрация, а по ней и активность ионов металла в растворе определяются анализом раствора или расчетом по весовым потерям металла в данном растворе. В этом расчете не учитывается некоторое отличие активности ионов металла в приэлектродном слое, определяющей значение обратимого потенциала, от рассчитываемой средней активности ионов металла в электролите.
Расчет активности ионов металла в растворе упрощается при образовании труднорастворимых продуктов коррозии. В этом случае она определяется из произведения растворимости труднорастворимого соединения.
Величина потенциала может служить относительной мерой коррозионной стойкости металла в данной среде. Обычно для оценки коррозионного поведения измерения проводят в растворах 3%NaCl или 5% NaCl + 0,5% CH3COOH, стандартных средах, рекомендованных для сравнения коррозионной стойкости металлов и покрытий российскими ГОСТами и международным стандартом NACE. При этом, чем положительнее потенциал изучаемого электрода, тем большей коррозионной стойкостью может обладать материал. Существует мнение, что если потенциал металла в исследуемой среде положительнее, чем его равновесное значение, то металл коррозии не подвергается, так как пассивируется и тем значительнее, чем больше разница в значениях стандартного и стационарного потенциалов. При отклонении стационарного потенциала от стандартного равновесного в большинстве случаев наблюдается активация коррозионного процесса. Следует, однако, заметить, что это лишь приблизительная сравнительная оценка коррозионного поведения. Для более объективных выводов необходимы измерения потенциала в течение продолжительного времени, а для количественной оценки – дополнительные весовые, аналитические и электрохимические методы измерений, а также исследования изменения поверхности в процессе коррозии.
В данной работе материалами для исследования служат образцы металлов: сталь СТ.3, никель, цинк, медь, титан, и др. а также покрытия меди на стали, никеля на стали, оксидные покрытия, полученные электрохимическими методами.
Измерения проводят при помощи потенциостата IPC-PRO. Значения разности потенциалов между исследуемым электродом и электродом сравнения (ЭДС, Е) записывают в автоматическом режиме при помощи компьютера. Электродом сравнения служит насыщенный хлоридсеребряный электрод, имеющий потенциал ЕAgCl|Ag = 0,201 ±0,003 В относительно нормального водородного электрода при температуре 250С. При этом значение потенциала Е(нвэ) изучаемого металла относительно нормального водородного электрода пересчитывается по формуле:
Е(нвэ) = Ехсл + Еизм
где Еизм - значение разности потенциалов между исследуемым образцом и хлоридсеребряным электродом, В
Ехсл - потенциал стандартного хлоридсеребряного электрода, В.
Для расчёта обратимого потенциала металла в данной среде активность иона металла считают равной 10-6, Обратимый потенциал деполяризующей реакции рассчитывают по формуле:
ЕН+/Н2 = -0,059 рН в случае коррозии с водородной деполяризацией
и по формуле:
Е
Принципиальная схема измерительной установки представлена на рис.1.
|
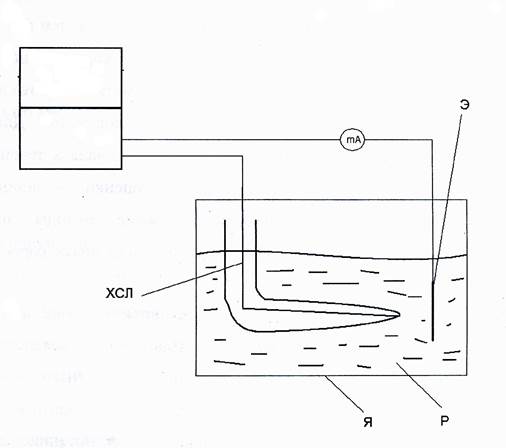
Рис.1

П - потенциостат
Я – электролитическая ячейка ЯСЭ-2,
Э – исследуемый электрод,
Р - раствор, в котором определяется электродный потенциал металла.
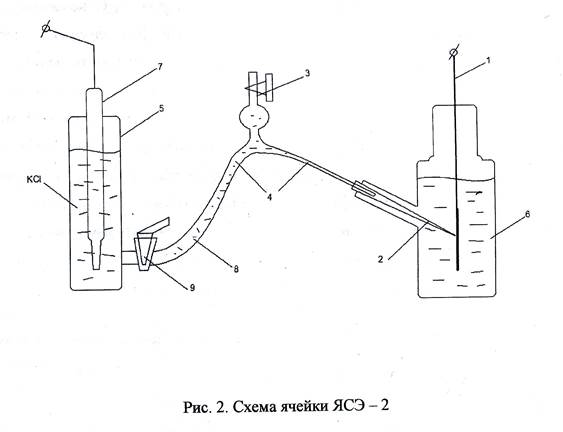
Все измерения производят в стандартной электрохимической ячейке ЯСЭ-2, в центральной части которой находится исследуемый образец.
Схема ячейки представлена на рис. 2. К поверхности образца (1) подведён стеклянный капилляр(2), соединённый с ключом(3), с двумя каналами(4 и 5) Один из них заполнен тем же исследуемым раствором, что и центральная часть ячейки(6). Электрод сравнения (7) опущен в ёмкость (5), соединённую с центральной частью ячейки. Эта ёмкость заполнена насыщенным раствором KCl. Для исключения смешивания растворов переходная трубка (8) перекрывается с помощью крана (9) между двумя каналами ключа.
Порядок выполнения работы.
1. Получить задание у преподавателя: исследуемые материалы и покрытия, а также составы растворов, в которых производятся измерения.
2. собрать схему экспериментальной установки для измерений как показано на рис.1.
3. Образцы в виде пластины обезжирить органическим растворителем (ацетоном, спиртом), промыть дистиллированной водой, высушить фильтровальной бумагой и укрепить в специальном держателе в электролитической ячейке, как показано на рис.2
4. Ячейку заполнить испытуемым раствором в соответствии с заданием. Электрод, укреплённый в держателе, установить в непосредственной близости от капилляра электролитического ключа. С помощью проводов соединить электрод сравнения и рабочий (исследуемый) электрод с соответствующими клеммами потенциостата.
5. Включить управляющую программу на компьютере IPC-Pro, выбрать в меню
6. «ПРИБОР» Панель управления,
7. «ГРАФИК» Выбор осей Е-t,
8. В меню «ГРАФИК» выбрать опцию «НАЗВАНИЕ, КОММЕНТАРИИ»
9. Записать в окне условия испытаний. «ОК».
10. Измерения проводить в течение 20-30 минут до установления постоянного значения потенциала рабочего электрода в данном растворе.
11. Сохранить файл в памяти компьютера, создав папку на рабочем столе под собственной фамилией.
12. В меню «ГРАФИК» выбрать опцию «ТАБЛИЦА РЕЗУЛЬТАТОВ» и скопировать результаты измерений в таблицу Excel. Результаты сохранить в своей папке.
13. Затем извлечь электрод из раствора, промыть дистиллированной водой и описать состояние поверхности металла или покрытия.
14. В ячейку поместить следующий рабочий электрод и повторить измерения.
15. Полученные результаты представить в виде графика, построенного по результатам измерений в Excel.
Сопоставляя результаты, сделать вывод о коррозионной стойкости исследуемого материала в данной среде. Описать внешний вид поверхности металла или покрытия. Оценить коррозионную стойкость металла или покрытия в данной среде.
Требования к отчёту.
Отчёт должен содержать формулировку задания, схему измерения, теоретическую часть, график хронопотенциограмм (зависимость изменения потенциала электрода от времени экспозиции образца в растворе), таблицу с данными измерений потенциалов и выводы по работе. Выводы основываются на результатах измерений потенциалов металлов и покрытий. Определяется склонность поверхности материала к коррозионному разрушению или коррозионная стойкость в заданном растворе.
Вопросы для самопроверки:
1. Цель работы. Контролирующий фактор коррозии.
2. Определение равновесного (обратимого) потенциала. Расчёт по уравнению Нернста.
3. Стационарный потенциал. Отличие от обратимого потенциала металла. Способ определения.
4. Расчёт степени контроля коррозионного процесса.
Список литературы
1. Левин А.И., Помосов А.В. Лабораторный практикум по теоретической электрохимии. М.: Металлургия, 1975.- 294 с.
2. Исаев Н.И. Теория коррозионных процессов. Учебник для вузов. М.: Металлургия, 1997.-361с.
 2015-04-30
2015-04-30 1427
1427






