Цель: изучить свойства кислот.
Техника безопасности: эксперименты необходимо проводить с соблюдением правил техники безопасности. Особую осторожность проявлять при работе с серной, азотной, соляной кислотами.
Оборудование и реактивы: штатив с пробирками,пробиркодержатель, пипетки на 1 мл. и резиновая груша, спиртовка, химический стакан, фильтровальная бумага, металлическая ложечка для сжигания, алюминий и цинк(гранулы),медная проволока дистиллированная вода, индикаторы: метиловый оранжевый, фенолфталеиновый, универсальная лакмусовая бумага; оксид меди(II)порошок, сера, растворы: гидроксид натрия NaOH,гидроксид калия KOH, серная кислота H2SO4 , соляная кислота HCl, азотная кислота HNO3 .
Перед выполнением работ необходимо проработать инструкции: №4
Ход работы:
Опыт№1 Получение сернистой кислоты.
В металлической ложечке сжигаем немного серы, опускаем ложечку с горящей серой в сухой стакан, прикрыв сверху фильтровальной бумагой. Когда сера сгорит, ложечку вынимаем и наливаем в стакан немного дистиллированной воды, затем тщательно перемешиваем. Газ который выделился при сжигании растворяется в воде. Мы проверяем это при помощи универсальной индикаторной бумаги, цвет её становится красным,а это означает что среда в получившемся растворе стала кислая,а была нейтральная.
Химизм процесса:
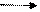 S +O2 SO2
S +O2 SO2
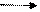 SO2 + H2O H2SO3 (сернистая кислота)
SO2 + H2O H2SO3 (сернистая кислота)
Опыт №2 Действие индикаторов на растворы кислот.
Берём любую из предоставленных нам кислот и проверяем, как взаимодействуют с ней различные индикаторы.
| Название индикатора | Цвет индикатора | Цвет индикатора после взаимодействия с кислотой |
| Метиловый оранжевый (м-о) | оранжевый | розовый |
| Фенолфталеиновый (ф-ф) | бесцветный | бесцветный |
| Универсальная лакмусовая бумага | оранжевый | красный |
Опыт №3 Взаимодействие кислот с металлами.
Берём три пробирки. В первую пробирку помещаем гранулу алюминия (Al) и приливаем соляную кислоту (HCl) наблюдаем выделение газа в виде появления пузырьков в растворе и на грануле алюминия. Во вторую пробирку помещаем гранулу цинка (Zn) и приливаем серную кислоту (H2SO4) наблюдаем выделение газа в виде появления пузырьков в растворе и на грануле цинка (Zn). В третью пробирку помещаем кусочек медной проволоки (Cu) наблюдаем отсутствие реакции,т.к в ряду активности металлов медь стоит после водорода следовательно это не активный металл.
Химизм процесса:


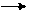 HCl + Al AlCl3 + H2
HCl + Al AlCl3 + H2
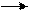 H2SO4 + Zn ZnSO4 + H2
H2SO4 + Zn ZnSO4 + H2


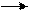 HNO3 + Cu
HNO3 + Cu
Опыт №4 Взаимодействие кислот с основными оксидами.
Берём пробирку(предварительно проверяем их на наличие сколов и трещин, чтобы не лопнули при нагревании)перед нагреванием устанавливаем пробирку в пробиркодержателе, поджигаем спиртовку. Помещаем в пробирку оксид меди (СuO) примерно пол шпателя и приливаем к ней 1мл серной кислоты H2SO4 . Полученный раствор нагревают на спиртовке(сначала прогревают полностью всю пробирку после чего фиксируют дно пробирки в верхней части пламени спиртовки направив отверстие пробирки от себя).Наблюдаем изменение цвета раствора из тёмно-коричьнивого в голубой.
Химизм процесса:
 CuO + H2SO4 CuSO4 + H2O
CuO + H2SO4 CuSO4 + H2O
Опыт№5 Реакция нейтрализации.
Берём щёлочь, приливаем в пробирку 1мл, затем добавляем несколько капель фенолфталеина, наблюдаем, как бесцветный раствор KOH окрашивается в малиновый цвет (Фенолфталеиновый в щёлочи малиновый), затем к полученному раствору приливаем серную кислоту до тех пор пока раствор не обесцветится.
Химизм процесса:
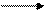 2NaOH + ф-ф + H2SO4 Na2SO4 + 2 H2O + ф-ф
2NaOH + ф-ф + H2SO4 Na2SO4 + 2 H2O + ф-ф
 2015-04-30
2015-04-30 756
756






