Могут встретится два случая:
1)оба компонента присутствуют и в паровой,и в жидкой фазах;
2) в жид фазе присутствует только один из компонентов.
Первый случай отвечает состоянию системы, при котором пары обоих компонентов являются насыщенными, а в жидкости вследствие нерастворимости компонентов имеются 2 фазы(ув+насыщ.водяной пар).
Число степеней свободы такой системы равно 1. т.е. достаточно задаться температурой системы чтобы определить равновесное состояние системы(давление системы и состав паров).
Давление при заданной температуре не зависит от соотношения масс жидких фаз и поэтому равно сумме давлений насыщенных паров компонентов, т.е.
Paz=pa+pz=Pa+Pz
В соответствии с законом дальтона состав паровой фазы определится так:
Ya’=pa/paz=Pa/(Pa+Pz) (1)
Yz’=1- Ya’= pz/paz
Удельный массовый расход одного компонента по отношению к другому, например расход водяного пара Z, затрачиваемого на перегонку массы ув G, определится следующим образом:
Z/G=(1- ya)/ya=PzMz/PaMa=(π-Pa) /PaMa
.π- внешнее давление системы.
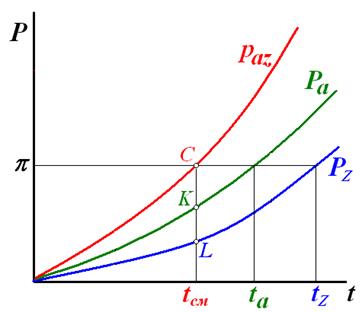 Отсюда следует, что относительный расход отпаривающего агента тем меньше, чем меньше его мольная масса.
Отсюда следует, что относительный расход отпаривающего агента тем меньше, чем меньше его мольная масса.
Во втором случае один из компонентов присутствует в виде перегретых паров, а жидкая фаза только одна(ув+инертный газ). Число степеней свободы равно 2.
Допустим, что в жид присутствует компонент а, а пары другого компонента z являются перегретыми, выбор внешнего давления π при заданной температуре равноценен выбору парциального давления pz’ так как pz= π-pa= π-Pa. При выбранных значениях температуры и давления состав паровой фазы и расход отпаривающего агента Z могут быть вычислены по уравнению (1).
 2015-05-05
2015-05-05 1454
1454








