Добавление к природной воде извести сопровождается протеканием ряда реакций. В результате диссоциации молекул извести по уравнению:

 Са(ОН)2 Са2+ + 2ОН-,
Са(ОН)2 Са2+ + 2ОН-,
в растворе повышается концентрация ионов гидроксила (рис.1.3). Существовавшее в природной воде углекислотное равновесие смещается вправо, поскольку увеличение концентрации ионов гидроксила приводит к связыванию ионов Н+ в малодиссоциированные молекулы воды:

 СО2 + Н2О Н2СО3;
СО2 + Н2О Н2СО3;
 Н2СО3 Н+ + НСО3-;
Н2СО3 Н+ + НСО3-;

 НСО3- Н+ + СО3-.
НСО3- Н+ + СО3-.
Введением ионов гидроксила в стехиометрическом количестве вся свободная углекислота и бикарбонат - ионы переводятся в карбонат - ионы. Увеличение в растворе концентрации карбонат - ионов вызывает реакцию образования труднорастворимого карбоната кальция:
 Са2+ + СО32- СаСО3¯.
Са2+ + СО32- СаСО3¯.
Добавление к воде извести в количестве, большем чем это необходимо для превращения СО2 и ионов НСО3- в карбонат - ионы, вызывает дальнейшее повышение в растворе концентрации гидроксила. Присутствующие в природной воде ионы Мg2+ с ионами ОН- образуют малорастворимое соединение - гидроокись магния Mg(OH)2:

 Мg2+ + 2ОН- Мg(ОН)2 ¯.
Мg2+ + 2ОН- Мg(ОН)2 ¯.
В результате известкования происходит снижение щелочности и жесткости. Общее солесодержание воды в результате снижения жесткости и щелочности при известковании всегда уменьшается.
| |||||||
 | |||||||
 |  | ||||||
а) б)
Рис.1.3 Известкование
На АЭС применено совмещение стадий известкования и коагуляции. Это совмещение приводит к снижению общей жесткости и щелочности природной воды, снижению степени дисперсности примесей в обрабатываемой воде.
Основным аппаратом для умягчения воды и осаждения является осветлитель. Процессы протекающие в осветлителе соответствуют описанным выше и рассматриваются в главе 4.
Обработка воды методом коагуляции и известкования является достаточно эффективным методом удаления грубодисперсных примесей. К недостаткам метода следует отнести:
- большой расход реагентов;
- сложность процесса, связанная с точной дозировкой реагентов и необходимостью поддержания в узком диапазоне температуры обрабатываемой воды и величины рН;
- образование большого количества шлама и сложностей с его захоронением.
1.3. ФИЛЬТРАЦИЯ
Для очистки воды от взвешенных частиц наряду с соосаждением используется фильтрация воды через слой зернистого материала. Фильтрация применяется для очистки вод от коллоидно-дисперсных примесей.
Очистка воды фильтрацией обусловлена, с одной стороны, адгезией взвешенных частиц на поверхности материале зернистого слоя, а с другой - механическим задержанием взвеси в порах, образованных зернами фильтрующего материала.
Адгезия характеризует взаимное притяжение частиц различных тел в области их соприкосновения (на поверхности раздела), обусловленное силами межмолекулярного взаимодействия между этими телами. Адгезией объясняется слипание различных тел, а также смачивание.
Чтобы произошла адгезия, необходимо сближение частиц. В сближении частиц взвеси с зернами фильтрующего материала участвуют гравитационные силы и силы инерции. При малой скорости фильтрации наибольшую роль играют силы тяжести. При увеличении скорости движения жидкости по каналам между зернами частицы взвеси, двигаясь по инерции, отклоняются от направления движения жидкости и подходят к зернам фильтрующего материала. Если взвешенные частицы и фильтрующий материал имеют заряды разных знаков, то в процессе сближения участвуют и электростатические силы.
Разделяют два режима фильтрации: быстрый и медленный. На АЭС принят метод быстрой фильтрации, который заключается в пропуске воды под напором, создаваемым внешним источником (насосом), через слой крупнозернистого фильтрующего материала. Быстрая фильтрация используется чаще всего совместно с коагуляцией в качестве предварительной очистки.
Для более эффективной очистки воды фильтрующий материал должен иметь максимально высокое сродство к продуктам коррозии и высокую пористость. Так как частицы продуктов коррозии имеют, как правило, отрицательный заряд, в качестве фильтрующего материала должны использоваться катиониты, причем предпочтение должно отдаваться материалам с развитой поверхностью, например сульфоуглю или дробленному антрациту.
Фильтрацию осуществляют на механических фильтрах. Конструкция фильтров рассматривается в главе 2.
В процессе улавливания взвешенных частиц фильтрующий материал загрязняется, в результате чего возрастает его гидравлическое сопротивление или наблюдается проскок взвешенных частиц в фильтрат.
Для удаления загрязнений фильтрующий материал промывают током воды снизу вверх с расходом, обеспечивающим расширение загрузки примерно в 1,5 раза, что позволяет зернам фильтрующего материала свободно перемещаться в потоке воды. Отмывающиеся с поверхности зерен частицы загрязнений и измельченные частицы фильтрующего материала удаляются вместе с водой. Для повышения эффективности промывки и снижения расхода промывочной воды производится взрыхление фильтрующего материала сжатым воздухом.
1.4. ИОННЫЙ ОБМЕН
Сущность ионного обмена заключается в извлечении из водных растворов различных ионов посредством обмена их на другие ионы, входящие в состав фильтрующих материалов ионитов.
В природной воде находятся примеси в растворенном состоянии и диссоциированы на катионы (Ca2+, Mg2+, Na+ и др.) и анионы (HCO3-, CL-, SO42-, HSiO3- и др.). Следовательно, обессоливание воды ионитами должно предусматривать освобождение ее и от катионов и от анионов.
Обработка воды методом ионного обмена экономически выгодна при солесодержании воды, не превышающим 1 г/кг. В противном случае ионообменные смолы быстро истощаются. Замена фильтрующего материала, в виду большой стоимости ионитов, обходится дорого, а регенерация приводит к появлению большого количества вод, требующих нейтрализации.
В зависимости от того, какой ион поступает в воду рассматривают Н+-катионирование и ОН--анионирование. Кроме этого, рассматривается совместное Н-ОН-ионирование воды.
При этом происходят следующие процессы:

 RH+ + Na+ RNa+ + H+,
RH+ + Na+ RNa+ + H+,

 AOH- + CL- ACL- + OH-,
AOH- + CL- ACL- + OH-,
в результате в воду поступают ионы H+ и OH- и образуют молекулу воды.
Применение метода ионного обмена стало возможным после освоения промышленностью производства синтетических смол.
На ХВО реализация данного метода осуществляется на цепочках обессоливания и ФСД, БОУ на ФСД, на СВО - 3,4,5,6,7.
Применение в схемах последовательного использования Н+ и ОН- фильтров обусловлено оптимальными режимами работы фильтров в кислой и щелочной среде.
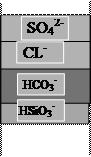
Назначение Н+-катионирования воды - замена содержащихся в воде катионов на ионы водорода. Применяемые на водоподготовке ионообменные материалы проявляют селективность по отношению к катионам, характеризуемую сорбционным рядом Ca2+> Mg2+>Na+, поэтому кроме реакций обмена катионов на ион Н+ протекают реакции взаимного вытеснения катионов. Хуже сорбируемые ионы Na+ вытесняются из катионита лучше сорбируемыми ионами Ca2+ и Mg2+ (рис. 1.4 «а»).
В динамических условиях эти процессы приводят к образованию трех зон поглощения катионов. Впереди идущей является зона поглощения наименее сорбируемых ионов Na+, за ней следует смешанная зона поглощения ионов Mg2+ и Na+, затем смешанная зона поглощения ионов Ca2+, Mg2+,Na+. Суммарная ширина этих зон определяет высоту работающего слоя катионита, в пределах которого общая концентрация всех сорбируемых ионов снижается от исходной до практически нулевой. По мере истощения катионита зоны поглощения катионов перемещаются в направлении движения воды. Впереди идущий фронт натрия первым достигает границы слоя катионита. Этот момент соответствует проскоку натрия в фильтрат. На последующих этапах фильтрования все время, пока фронт натрия пересекает границу слоя катионита, концентрация иона натрия в фильтрате продолжает увеличиваться. Когда границу слоя катионита начинают пересекать смешанные зоны, в фильтрате появляются ионы магния и кальция, т.е. наступает проскок жесткости.
Процесс регенерации отработанного катионита соответствует протеканию реакций обмена ионов в направлении справа налево.
Нетрудно заметить, что в числе образующихся продуктов регенерации есть труднорастворимые соединения - сульфат кальция, а следовательно, существует реальная опасность выделения на зернах катионита твердой фазы гипса (CaSO4×2H2O). Наиболее распространенный способ предотвращения загипсовывания - применение для регенерации весьма разбавленных растворов серной кислоты.
На ХВО применен метод «голодная регенерация». Этим названием подчеркивается основная особенность этой технологии, а именно то обстоятельство, что регенерация отработанного катионита проводится с недостатком кислоты. При правильном осуществлении данного режима на протяжении всего рабочего цикла обеспечивается получение фильтрата с нулевой кислотностью и минимальной щелочностью.
Технология Н+-катионирования с «голодной регенерацией» использует принцип прямоточной регенерации: раствор кислоты, так же как и вода, фильтруется через катионит в направлении сверху вниз. Поскольку во всем объеме регенерационного раствора количество грамм-эквивалентов ионов Н+ меньше обменной емкости загруженного в фильтр катионита, в Н+-форму переводится не весь слой катионита, а какая-то его часть. Более полно регенерируются только самые верхние слои; далее по ходу регенерационного раствора степень регенерации отдельных слоев постепенно убывает. В самых нижних слоях, через которые проходит раствор, содержащий лишь продукты регенерации - сульфаты кальция, магния и натрия, катионит переводится в соответствующие солевые формы: CaR2, MgR2 и NaR.
В результате в слоях, которые находятся преимущественно в Н-форме, образуются сильные минеральные кислоты и угольная кислота. В нижерасположенных слоях ионы водорода сильных минеральных кислот обмениваются на ионы кальция, магния и натрия. Слабая угольная кислота, диссоциация которой в присутствии сильных кислот подавлена, значительную часть слоя проходит «транзитом» и обменивает некоторое количество ионов водорода уже в самых нижних слоях, обуславливая появление щелочности. С течением времени количество обменных ионов водорода в фильтре уменьшается, одновременно происходит их перемещение из вышележащих слоев в нижележащие. К моменту окончания рабочего цикла все количество введенных при регенерации ионов водорода оказывается израсходованным на разрушение щелочности обрабатываемой воды. Качество фильтрата на протяжении рабочего цикла фильтра с голодной регенерацией изменяется.
Остаточная щелочность понижается по мере истощения катионита по иону водорода, а в конце рабочего цикла резко возрастает. В отличие от обычной технологии Н+-катионирования, когда отключение фильтров на регенерацию производится по проскоку удаляемых катионов, окончание рабочего цикла Н+-катионитовых фильтров с «голодной регенерацией» устанавливается по повышению щелочности.
Метод регенерации катионита «голодной» нормой кислоты позволяет получать Н+-катионированную воду, не содержащую сильных минеральных кислот. Образующаяся при Н+-катионировании угольная кислота удаляется на следующих ступенях очистки. Расходование кислоты на «голодную регенерацию» в количестве, соответствующем теоретическому, не только улучшает экономику процесса Н+- катионирования, но и исключает возможность сброса кислых вод, в связи с чем сокращаются затраты на нейтрализацию сточных вод.
На установках СВО для регенерации катионитовых фильтров используется азотная кислота HNO3. Химические процессы, протекающие при этом, соответствуют процессам при регенерации серной кислотой.
На АЭС используется метод последовательного осуществления процессов Н+-катионирования и ОН--анионирования. Весьма простой по своей сути метод ионного обессоливания воды направлен на достижение требуемого эффекта очистки воды с минимальными затратами.
Процесс сорбции анионов сильных кислот сопровождается повышением рН раствора:
2ROH- + 2H+ + SO42- ® R2SO4 + 2H2O;
ROH- + H+ + CL- ® RCL- + H2O;
Находящиеся в Н-катионированной воде в недиссоциированном состоянии слабые кислоты H2CO3 и H2SiO3 по мере повышения рН начинают диссоциировать и участвовать в реакциях обмена на сильноосновном анионите:
ROH- + H+ + HCO3- ® RHCO3 + H2O;
ROH- + H+ + HSiO3- ® RHSiO3- + H2O.
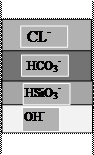
Кроме этих реакций протекают реакции взаимного вытеснения анионов, обусловленные селективностью ионообменного материала, характеризующийся следующим сорбционным рядом:
SO42- > CL- > HCO3- > HSiO3-.
Впереди идущей является зона поглощения наименее сорбируемой кремниевой кислоты, за ней следует смешанная зона поглощения угольной и кремниевой кислот, затем смешанная зона поглощения слабых кислот и хлоридов и, наконец, смешанная зона поглощения слабых кислот, хлоридов и сульфатов. Суммарная ширина всех зон определяет высоту работающего слоя анионита, в пределах которого концентрация всех сорбируемых анионов понижается от исходного до весьма малого значения, зависящего от степени регенерации анионита.
При регенерации анионитовых фильтров используют обычно раствор едкого натра. Реакции регенерации анионитового фильтра можно записать следующими уравнениями:
 R2SO42- + 2NaOH 2ROH + Na2SO4;
R2SO42- + 2NaOH 2ROH + Na2SO4;

 RCL- + NaOH ROH + NaCL;
RCL- + NaOH ROH + NaCL;
RHCO3- + NaOH® ROH + Na2CO3 + H2O;
RHSiO3- + NaOH ® ROH + Na2SiO3 + H2O.
Если при выполнении вспомогательных операций не будут соблюдаться определенные условия, в слой анионита могут попасть примеси, образующие в щелочной среде труднорастворимые соединения. Чтобы избежать выделения в слое анионита твердой фазы Mg(OH)2 и СаСО3, для взрыхления и отмывки анионита, а также для разбавления раствора едкого натра необходимо использовать обессоленную воду. В рабочем цикле, когда на анионит поступает кислая вода, твердая фаза Mg(OH)2 и СаСО3 постепенно растворяется, в результате чего в обессоленной воде появляется жесткость.
На АЭС в схеме обессоливания добавочной воды принята двухступенчатая схема одноименных ступеней ионирования, что позволяет понизить остаточные концентрации ионов в обрабатываемой воде. Эта схема требует правильного выбора ионообменных смол для ОН--анионитовых фильтров. ОН--анионитовые фильтры первой ступени загружаются слабоосновным анионитом АН-31, а фильтры второй ступени - сильноосновным анионитом АВ-17-8. Слабые угольная и кремневая кислоты низкоосновным анионитом не сорбируются. Кроме этого, использование низкоосновного анионита позволяет производить очистку воды от органических соединений (рис.1.4 «б»).
Технологические схемы раздельного Н+, ОН-- ионирования воды всегда дополняются конечной стадией совместного Н+-ОН--ионирования воды. Эта стадия осуществляется фильтрованием воды через слой перемешанных зерен катионита и анионита, находящихся соответственно в Н+ и ОН--формах. Для достижения глубокого обескремнивания воды необходимо применять смеси из сильноосновного анионита и сильнокислотного катионита. Аппараты, фильтрующий слой в которых представляет смесь катионита и анионита, получили название фильтров смешенного действия.
ФСД делятся по способу регенерации: с выносной регенерацией и с внутренней регенерацией. Первоначально, по проекту, оба эти способа применялись в технологических схемах систем ХВО. В настоящее время используется только метод с выносной регенерацией. Для эффективного использования обменной емкости ионообменных материалов и получения максимальной степени регенерации смол необходимо добиваться наибольшей полноты разделения смеси ионитов перед их регенерацией. Увеличение доли анионита, попавшего в катионит, обуславливает снижение емкости ФСД по анионам; увеличение доли катионита, попавшего в анионит, приводит к снижению рабочей обменной емкости ФСД по катионам в последующем фильтроцикле.
Использование ФСД в качестве последней степени очистки позволяет поддерживать кислотно-щелочное равновесие добавочной воды или конденсата.
Метод ионного обмена имеет как преимущества, так и недостатки. К преимуществам следует отнести высокую степень очистки, простоту и надежность. К недостаткам можно отнести высокую стоимость ионообменных материалов, большой расход реагентов, необходимость нейтрализации после регенерационных вод, низкую термостойкость материалов и обработку воды при солесодержании не выше 1 г/л.
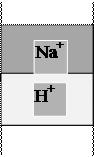 | 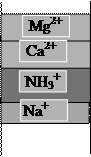 | ||||||
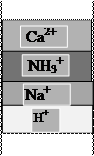 | |||||||
 | |||||||
I II III IV
а) Н+ - катионирование
 | |||||||
 | |||||||
 | |||||||
 | |||||||
I II III IV
б) ОН- - анионирование
Рис. 1.4 Ионный обмен
1.5. ДЕГАЗАЦИЯ
Дегазацией называются процессы связывания или удаления из обрабатываемой воды растворенных в ней газов: углекислого газа, кислорода. Удаление из воды растворенных газов - важная часть комплексного технологического процесса обработки воды. Необходимость этого процесса вызвана стремлением уменьшить интенсивность коррозии внутренних поверхностей оборудования под действием растворенных в воде агрессивных газов.
В практике АЭС применяют химический и термический метод дегазации.
Химический метод дегазации применяется при ведении водно-химических режимов 1 и 2 контуров.
В 20-х годах было предложено устранять растворенный кислород, пропуская воду через слой стальных стружек, которые при этом корродировали и связывали кислород:
4Fe +3O2 + 6H2O = 4Fe(OH)3.
Однако опыт показал недостаточную эффективность этого способа.
Позже в 30-х годах был предложен сульфит натрия:
2Na2SO3 + O2 = 2Na2SO4.
Следует отметить, что реакция между сульфитом и растворенным кислородом протекает медленно. Это обстоятельство ограничило применение сульфитирования, и в настоящее время для удаления кислорода используют гидразин:
N2H4 + O2 = N2 + 2H2O.
На установках водоподготовки получил признание термический метод дегазации. Это связано с тем, что термическая дегазация - универсальный способ удаления из воды любого газа.
Принцип организации термической дегазации заключается в создании контакта воды с паром. В паровой фазе, контактирующей с водой, парциальное давление газа, удаляемого из воды, близко к нулю, что является необходимым условием правильной организации процесса дегазации.
При пропускании пара через воду происходит ее нагрев, который организуют таким образом, чтобы температура воды стала равной температуре кипения при том давлении, котором проводится процесс деаэрации. При подогреве воды до температуры насыщения при данном давлении парциальное давление газа над водой снижается до нуля и растворимость его также падает до нуля. Вследствие нарушения равновесия в системе происходит выделение избыточных газов из воды.
Этот способ основан на законе Генри, характеризующим зависимость между концентрацией в воде растворенного газа и его парциальным давлением:
Сг = kгрг = kг(робщ.- рн2о),
где Сг - концентрация растворенного в воде газа; kг - коэффициент абсорбции газа водой; робщ.- общее давление; рн2о - парциальное давление водяного пара.
Отсюда видно, что для удаления газа из воды, необходимо создать условия, при которых парциальное давление его над поверхностью воды было бы равно нулю.
Дегазацию воды проводят в аппаратах: деаэраторах и дегазаторах. На ХВО используются два типа деаэратора: деаэратор атмосферного типа и вакуумный деаэратор.
1.6. ДИСТИЛЛЯЦИЯ
Дистилляция является наиболее старым и до появления ионного обмена единственным способом очистки от растворимых солей. Примером дистилляции может служить круговорот воды в природе - испарение воды морей и океанов с последующим выпадением осадков в виде дождя, снега или росы.
В практике обработки воды дистилляцию проводят, испаряя воду в дистилляторах (испарителях, выпарных аппаратах), с последующей конденсацией пара в охладителях (конденсаторах).
Очистка воды основана на весьма малой растворимости примесей в паре. Переход вещества из кипящей воды в пар снижается с уменьшением давления пара и при значениях, принятых в практике обработки воды, может не учитываться.
Загрязнение пара за счет капельного уноса зависит от размера капель, образующихся при кипении воды, и содержания в них примесей. Так как содержание примесей в воде, обрабатываемой методом дистилляции на АЭС, велико, капельный унос приобретает основное значение.
Механизм образования капель при всплывании пузыря пара: жидкая пленка оболочки всплывшего пузыря постепенно утоняется в верхней части, в результате чего происходит разрыв. Остатки жидкой пленки стягиваются к нижней точке пузыря и образуют кольцевую волну. При этом возникают всплески и выброс жидкости в виде капель разного размера.
Если капли достаточно крупны (это бывает при кипении чистой воды), они поднимаются на небольшую высоту и падают обратно. Унос таких капель относительно мал. При наличии в воде загрязняющих веществ, способствующих упрочнению жидкой пленки, разрушение пузыря происходит при значительном ее утонении. При этом одновременно возникает несколько разрывов и отдельные части пленки в виде мельчайших капель могут уноситься с паром.
Высота подъема капли будет неограниченно большой, когда капля из-за своего малого размера перейдет в режим витания. Если скорость пара больше скорости витания, капля будет унесена потоком пара, если меньше скорости витания - упадет обратно.
На размер капель помимо общего солесодержания оказывают влияние присутствие в воде поверхностно - активных веществ и кратность циркуляции пароводяной смеси. С целью снижения влияния капельного уноса на чистоту дистиллята применяют сепарацию пара, промывку его частью дистиллята, снижение концентрации примесей в испаряемой воде увеличением продувки, уменьшение кратности циркуляции и другие способы.
При промывке пар барботирует в виде мелких пузырьков через слой промывочной воды (флегмы) и оставляет в ней большую часть примесей. При последующем отделении пара от воды происходит унос паром уже капелек промывочной воды, содержание примесей в которой намного меньше. Для более эффективной промывки пара используют двухступенчатую промывку, при этом флегма перетекает со второй ступени промывки на первую. Это дает возможность получить высокий коэффициент очистки.
Дистилляция - один из наиболее эффективных способов обработки вод, дающий наибольший коэффициент очистки (Коч=104) и не требующий затраты реагентов.
В то же время дистилляция не является полностью универсальным способом очистки вод, так как содержащиеся в воде растворенные газы в процессе выпаривания улетучиваются вместе с паром. Дистилляция вод, содержащих поверхностно-активные вещества, также представляет трудности вследствие вспенивания концентрата и попадания высокоактивной пены в дистиллят.
К недостаткам следует отнести сложность и высокую стоимость оборудования. Несмотря на это, благодаря высокому коэффициенту очистки и малому объему отходов, дистилляция находит широкое применение на АЭС.
 2015-05-05
2015-05-05 3315
3315








