Согласно теории Бренстеда кислоты – это соединения (молекулы или ионы), которые являются донорами протонов. Основания по Бренстеду – это соединения, способные присоединять протон (акцепторы протонов). Для взаимодействия с протоном основание должно иметь пару электронов (неподеленная электронная пара или электроны p-связи). Протон от кислоты переходит к основанию, при этом оставшаяся частица сохраняет электронную пару, которая ранее образовывала связь с протоном. Эта частица теоретически также может присоединять протон, т.е. является сопряженным основанием.
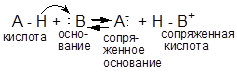

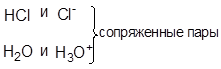
Между кислотой и основанием сопряженной пары существует взаимосвязь: чем сильнее кислота, тем слабее образуемое ею основание, и наоборот. Например, уксусная кислота слабее, чем соляная, и, соответственно ацетат-ион – более сильное основание, чем анион хлора.
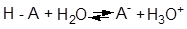
Константа такого равновесия выражается уравнением:
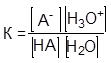
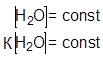
Константа кислотности:
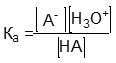
Для уксусной кислоты эти уравнения примут следующий вид:
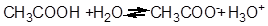
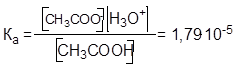
Значения Ка очень малы, оперировать ими неудобно, поэтому применяют отрицательный логарифм от величины Ка.
рКа = lgКа
рКа(СН3СООН) = -lg1,79 . 10-5 = 4,76
Чем выше величина Ка и чем ниже величина рКа, тем сильнее кислота.
В большинстве органических соединений содержится водород, поэтому потенциально все они являются кислотами Бренстеда.
В зависимости от того, с каким атомом связан отщепляемый протон, кислоты можно разделить на несколько групп:
О-Н – кислоты (карбоновые кислоты, спирты, фенолы и т.д.)
S-H – кислоты (тиолы)
N-H – кислоты (аммиак, амины, амиды)
C-H – кислоты (насыщенные и ненасыщенные углеводороды)
Основания Бренстеда для образования связи с протоном должны содержать электронную пару, поэтому основными свойствами обладают соединения, в состав которых входят атомы со свободной электронной парой (О, N, S, Hal), или содержащие p-связи.
В соответствии с этим основания Бренстеда можно разделить на 2 группы:
Основания Бренстеда
| n – основания содержат неподеленную пару электронов | p - основания содержат электроны p-связи |
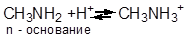
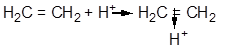
p - основания p - комплекс
Чем стабильнее анион, тем сильнее сопряженная кислота.
Стабильность аниона зависит от:
1. ЭО и поляризуемости атома в кислотном центре;
2. наличия сопряжения;
3. характера заместителей в органическом радикале;
4. влияния растворителя.
Рассмотрим каждый фактор подробно:
1) ЭО и поляризуемость атома в кислотном центре
Кислотный центр – это элемент и связанный с ним атом водорода.
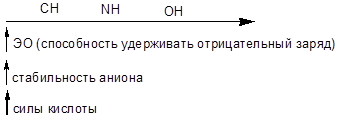
Для СН - кислот:
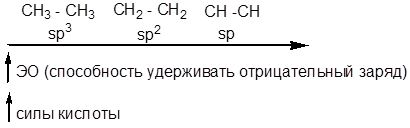
Поляризуемость элемента возрастает с увеличением радиуса атома и расстояния электронов от ядра.
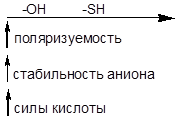
То есть тиолы более сильные кислоты, чем спирты
2) Наличие сопряжения
Фенол и карбоновые кислоты по кислотности значительно превосходят спирты, т.к. их анионы стабилизированы за счет р - p - сопряжения и делокализации отрицательного заряда:
Ацилат-ион и феноксид-ион стабилизированы за счет наличия сопряжения:

| 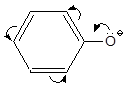
|
3) Характер заместителей в органическом радикале:
ЭА – заместители в радикале увеличивают силу кислоты, т.к. способствуют делокализации отрицательного заряда в анионе.
Действие ЭД – заместителей – противоположно
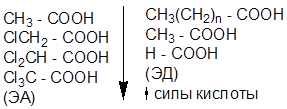
Для ароматических соединений:
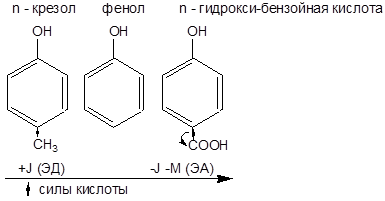
4) Влияние растворителя
Чем больше сольватация (гидратация) аниона, тем он более устойчив. Сольватация (гидратация) аниона растет с уменьшением его размера, т.к. увеличивается делокализацияя заряда.
| Трет-бутиловый спирт Изопропиловый спирт Этиловый спирт Метиловый спирт | 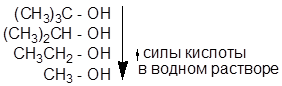
|
 2015-05-06
2015-05-06 888
888








