| Критерий | Классификация вод по степени загрязненности | ||
| Низкая загрязненность | Средняя загрязненность | Высокая загрязненность | |
| Содержание О2 Количество планктона Количество рыбы | 8 мг/л Малое Большое | 6 … 2 мг/л Большое Малое | < 2 мг/л Малое Отсутствует |
Метод Винклера позволяет точно измерить содержание кислорода. Метод основан на способности гидроксида марганца (II) окисляться в щелочной среде до гидроксида марганца (IV), количественно связывая при этом кислород. В кислой среде гидроксид марганца (IV) вновь переходит в двухвалентное состояние, окисляя при этом эквивалентное связанному кислороду количество йода. Выделившийся йод оттитровывают тиосульфатом натрия. Предел обнаружения растворенного кислорода 0,05 мг/л.
Цель работы: Определить содержание кислорода в пробе природной воды.
Материалы и оборудование: 10 мл щелочного раствора йодида калия (3,3 г NaOH; 2,0 г КI в 10 мл дистиллированной воды); 10 мл раствора хлорида марганца (4,0 г MnCl2 в 10 мл дистиллированной воды); 5 мл концентрированной соляной кислоты; 0,5%-ный раствор крахмала (в качестве индикатора), дистиллированная вода; 0,01 М раствор тиосульфата натрия; пипетки на 5 мл, бюретка, белая кафельная плитка, 3 конические колбы, калиброванный сосуд с притертой пробкой.
Порядок выполнения работы
1. Осторожно, не расплескивая, набрать 250 мл воды в калиброванный сосуд и оставитьего под водой, чтобы в него не попадали пузырьки воздуха.
2. В пробу воды пипеткой добавить 2 мл хлорида марганца и 2 мл щелочного раствора йодида калия; конец пипетки должен касаться дна сосуда. Более тяжелый раствор солей вытеснит из сосуда равное количество воды, находящейся в верхнем слое.
3. Добавить 2 мл концентрированной соляной кислоты и закрыть сосуд так, чтобы в нем не было пузырьков воздуха. Xopoшо потрясти сосуд для того, чтобы растворился осадок гидроксида марганца, выпавший в щелочной среде. При этом йодистые соединения окислятся, выделившийся йод окрасит раствор в желтый цвет.
4. Для исследования отлить из сосуда в коническую колбу 50 мл воды. Из бюретки оттитровать ее 0,01 М раствором тиосульфата натрия следующим образом:
а) постоянно встряхивая коническую колбу, доливать в нее раствор тиосульфата до тех пор, пока желтый цвет не побледнеет;
б) добавить 3 капли раствора крахмала и продолжать титровать, постоянно встряхивая колбу до тех пор, пока не исчезнет темно-синяя окраска крахмала.
Записать объем израсходованного тиосульфата натрия.
5. Дважды повторить операцию пункта 4 с 50 мл исследуемой воды и вычислить средний объем расходуемого тиосульфата (ā).
6. При использовании этих растворов 1 мл израсходованного 0,01 М тиосульфата соответствует 0,056 мл кислорода в условиях нормальной температуры и давления (НТД).
7. Рассчитать содержание кислорода в воде, мг/л, используя следующую формулу:
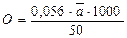 ,
,
где ā – объем тиосульфата, расходуемый на титрование 50 мл воды.
 2015-04-20
2015-04-20 448
448








