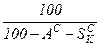Твердое и жидкое органическое топливо состоит из сложных химических соединений, содержащих углерод, водород, серу, кислород, азот, влагу и минеральную часть.
· C, H, Sл – горючая часть;
· O, N – внутренний балласт;
· W, A – внешний балласт.
Газообразное топливо представляет собой смесь горючих и негорючих газов с небольшой примесью пыли. Его состав:
· CH  = 80÷95%,
= 80÷95%, 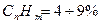 , H
, H  , CO, Н2S – горючая часть;
, CO, Н2S – горючая часть;
· 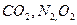 - негорючая часть.
- негорючая часть.
Один килограмм водорода выделяет при сгорании тепла в несколько раз больше, чем углерод. Один килограмм серы выделяет при сгорании тепла в 3,5 раза меньше, чем углерод.
Сера, содержащаяся в твердом топливе делится на:
· S 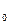 -органическую (входит в состав органических соединений);
-органическую (входит в состав органических соединений);
· Sк –колчеданная (входит в состав колчедана или пирита FeS2);
Sс -сульфатную(входит в состав сульфатов, не горит и переходит в золу и шлаки);
· Sл = S 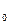 + Sк –летучая сера горит (окисляется кислородом воздуха).
+ Sк –летучая сера горит (окисляется кислородом воздуха).
По содержанию серы различают следующие виды мазута:
· S ≤0,5 мазут малосернистый;
· S ≥1,7 мазут высокосернистый;
· 0,5<S<1,7 мазут сернистый.
Жидкое и твердое топливо имеет сложный молекулярный состав, поэтому их состав выражается в процентах веса элементов. Топливо, на складе станции, называется рабочим. Состав топлива на рабочую массу записывается в следующем виде:
C 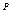 +H
+H 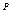 +S
+S 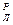 +N
+N 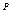 +O
+O 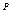 +A
+A  +W
+W  =100%
=100%
 Аналитическая масса – топливо, доведенное до воздушно-сухого состояния.
Аналитическая масса – топливо, доведенное до воздушно-сухого состояния.
Wа =Wр - Wвн
Рис. 14 Схема элементарного состава топлива
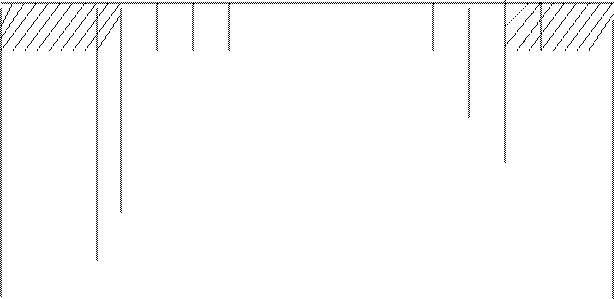

 W Wa O N H C S
W Wa O N H C S 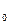 Sк Sс A
Sк Sс A
 C
C 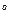 +H
+H 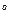 +N
+N 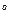 +S
+S 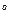 + O
+ O 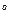 =100% W=A=Sк=0
=100% W=A=Sк=0
Органическая масса
 |
C 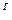 +H
+H 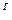 +S
+S 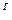 +N
+N 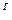 +O
+O 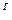 =100%
=100%
Горючая масса W=A=0
C 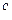 +H
+H 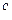 +S
+S 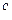 +N
+N 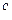 +O
+O 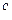 +A
+A 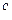 =100% Сухая масса W=0
=100% Сухая масса W=0
C 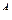 +H
+H 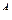 +S
+S 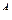 +N
+N 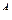 +O
+O 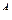 +A
+A 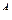 +W
+W 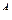 =100% Аналитическая масса
=100% Аналитическая масса
C 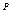 +H
+H 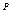 +S
+S 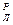 +N
+N 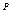 +O
+O 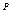 +A
+A 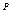 +W
+W 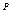 =100% Рабочая масса
=100% Рабочая масса

Пересчет состояния топлива с одной массы на другую ведется с помощью коэффициента пересчета 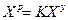 .
.
Таблица 1. Коэффициенты пересчета на различные массы топлива
| Искомая масса Задан- ная масса | рабочая | сухая | горючая | органическая | |||
| рабочая | 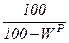
| 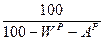
| 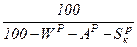
| ||||
сухая | 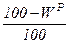 
| 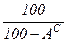
| |||||
| горючая | 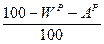
| 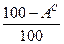
|  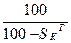
| ||||
| Органическая | 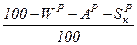
| 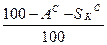
| 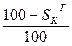
|
 |
При хранении и транспортировке топлива его зольность и влагосодержание могут изменяться.
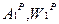 →
→ 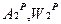 коэффициент пересчета при этом:
коэффициент пересчета при этом: 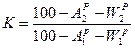 .
.
Теплота сгорания
Теплотой сгорания называется количество теплоты, выделившейся при полном сгорании единицы массы или объема топлива 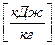 ,
, 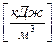 . Различают высшую и низшую теплоту сгорания. Высшей теплотой сгорания называется количество тепла, выделяемое при полном сгорании единицы топлива с учетом теплоты конденсации, образующейся при горении водяных паров. Низшая теплота сгорания – это количество тепла без учета теплоты конденсации.
. Различают высшую и низшую теплоту сгорания. Высшей теплотой сгорания называется количество тепла, выделяемое при полном сгорании единицы топлива с учетом теплоты конденсации, образующейся при горении водяных паров. Низшая теплота сгорания – это количество тепла без учета теплоты конденсации.
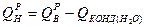
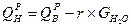 , где
, где
r = 600  - скрытая теплота парообразования.
- скрытая теплота парообразования.
Количество водяных паров получающихся при сжигании 1кг топлива
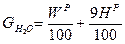
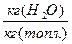 , где:
, где:
Wp/100-влага топлива (делим на 100, чтобы перейти от % к кг);
(запишем стехиометрическую реакцию окисления атомарного водорода)
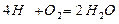
с учётом молекулярных весов (закон сохранения масс)
4кг+32кг=36кг
1кг+ 8кг = 9кг
9Нр./100-вес водяных паров, образующиеся при окислении 1 кг водорода топлива.
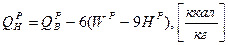
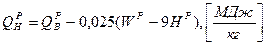
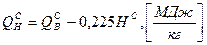
При изменении внешнего балласта топлива пересчет у низшей теплоты сгорания
проводится следующим образом:
При изменении балласта топлива 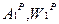 →
→ 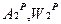 высшая теплота сгорания (
высшая теплота сгорания (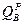 ) пересчитывается, как и состав топлива -
) пересчитывается, как и состав топлива - 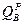 2=
2= 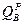 1*
1* 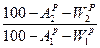
Пересчет низшей теплоты сгорания (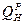 ) при изменении внешнего балласта топлива
) при изменении внешнего балласта топлива
1. при изменении зольности (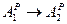 ) пересчет ведется аналогично составу топлива:
) пересчет ведется аналогично составу топлива:
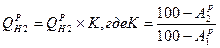
2. при изменении влажности топлива пересчет низшей теплоты ведется через высшую теплоту сгорания, которая пересчитывается аналогично составу топлива:
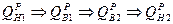
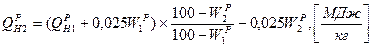
Для твердого и жидкого топлив теплота сгорания может быть примерно рассчитана по полуэмпирической формуле Менделеева.
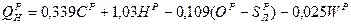 , Мдж/кг.
, Мдж/кг.
Теплота сгорания природного газа может быть рассчитана следующим образом:
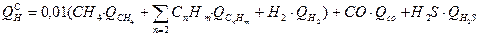
Теплота сгорания топлива определяется на калориметре. 
| Вид топлива | WP | AP | VГ | QНР (Мкал/кг) |
| % | ||||
| антрацит | 8..10 | 20..30 | 4..6 | 5,2..5,5 |
| каменный уголь | 5..25 | 10..50 | 8..45 | 3..6 |
| бурый уголь | 20..50 | 6..30 | 40..70 | 2,2..4,5 |
| сланцы | 10..20 | 55..60 | 80..90 | 2..2,7 |
| торф | 40..50 | 6..8 | 1,8..2 | |
| мазут | 1..3 | 0,1..0,3 | 9..9,1 | |
| газ | 8..11 |
лекция№4
 2015-04-30
2015-04-30 1633
1633