Под горением понимают процесс химического взаимодействия топлива и окислителя, при интенсивном выделении тепла, скачкообразном росте температур, концентрации продуктов горения и снижении концентрации окислителя. При горении происходит преобразование химической энергии топлива в тепловую энергию, идущую на нагрев продуктов сгорания.
Химические реакции, идущие с выделением тепла, называются экзотермическими.
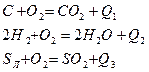
Химические реакции, идущие с поглощением тепла, называются эндотермическими.
Существуют и другие виды реакций: гомогенные, гетерогенные.
Интенсивность горения характеризуется скоростью химической реакции. Под скоростью гомогенной химической реакции понимают массовое количество вещества, которое реагирует в единицу объема, в единицу времени.
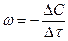
Считают, что скорость гомогенной реакции подчиняется закону действующих масс, т.е. пропорциональна произведению реагирующих веществ или масс.
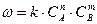 , где (1)
, где (1)
m и n – число молей реагирующего вещества, k – постоянная скорости горения.
Например:
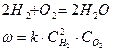
При данной температуре концентрация пропорциональна парциальному давлению соответствующего газа.
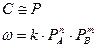 (2)
(2)
При сжигании твердого топлива парциальное давление паров продуктов газификации, а следовательно и их концентрации есть величины постоянные при данной температуре.
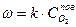 (3)
(3)
Константа скорости горения определяется по закону Аррениуса: 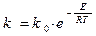
E –энергия активации;
R –газовая постоянная;
T–температура процесса в градусах °К.
Это выражение показывает, что в реакции участвуют не все молекулы топлива, а только молекулы, обладающие энергией активации, т.е. энергией, достаточной для разрушения внутренних связей.
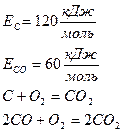
Для того, чтобы сообщить топливу достаточное количество энергии его необходимо подогреть.
. 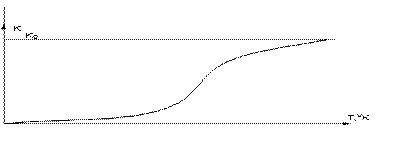
Рис. 16 Влияние температуры на величину константу скорости горения
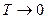
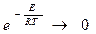
Таким образом, k показывает долю молекул, участвующих в процессе горения. k  - характеристика полного числа столкновений молекул реагирующих веществ.
- характеристика полного числа столкновений молекул реагирующих веществ.
Горение твердого топлива
Различают два периода:
1. сушка при температуре около 100°С. Время сушки зависит от влажности, от размеров кусков, от условий теплообмена.
2. горение состоящее из следующих стадий:
а) выход летучих и образование нелетучего остатка;
б) горение летучих;
в) горение нелетучего коксового остатка.
Примерно 90% времени занимает горение коксового остатка (С).
Учитывают также, что при этом выделяется основное количество тепла. Горение твердого топлива в основном определяется механизмом и кинетикой горения углерода.
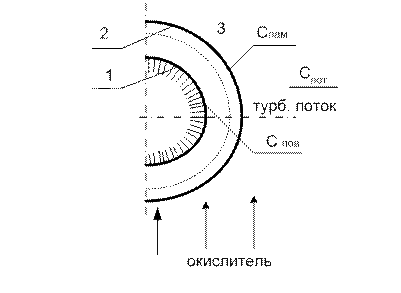
Рис. 17 Схема горения коксовой частицы
1. поверхность коксовой частицы
2. граница ламинарного слоя
3. турбулентный поток.
Данное горение протекает на поверхности и относится к гетерогенным реакциям: в этом процессе подводится кислород, который реагирует с частицами твердого топлива.
Скорость химической реакции зависит от скорости подвода кислорода к поверхности реагирования и от кинетики химической реакции.
Количество O 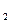 , подведенное в единицу времени можно определить.
, подведенное в единицу времени можно определить.
a) Поверхность ламинарного слоя
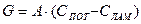 , А – коэф. турбулентной диффузии. (4)
, А – коэф. турбулентной диффузии. (4)
b) Поверхность частиц:
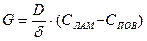 ,
, 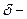 толщина ламинарного слоя. (5)
толщина ламинарного слоя. (5)
D – коэффициент молекулярной диффузии.
Совместное решение уравнений (4) и (5):
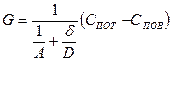 (6)
(6)
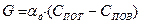
 (7)
(7)
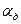 - константа скорости диффузии.
- константа скорости диффузии.
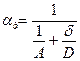
Таким образом, количество кислорода, подводимого к поверхности, является функцией: 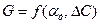 . В свою очередь
. В свою очередь 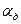 является функцией, зависящей от скорости обтекания, размера частицы и вязкости потока:
является функцией, зависящей от скорости обтекания, размера частицы и вязкости потока: 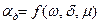 .
.
При установившемся процессе горения скорость процесса равна скорости подвода кислорода:
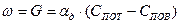 (8)
(8)
С другой стороны, ранее получено, что скорость гетерогенного горения равна:
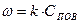 (9)
(9)
Совместное решение уравнений (8) и (9) дает выражение для скорости горения:
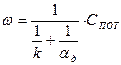 (10)
(10)
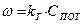 (11)
(11)
где 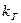 - приведенная константа скорости горения, представляющая из себя единицу, деленную на сопротивление процессу горения.
- приведенная константа скорости горения, представляющая из себя единицу, деленную на сопротивление процессу горения.
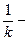 химическое (кинетическое) сопротивление;
химическое (кинетическое) сопротивление;
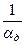 - диффузионное сопротивление;
- диффузионное сопротивление;
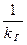 - общее сопротивление.
- общее сопротивление.
В зависимости от соотношения этих сопротивлений, на которые влияют от температура процесса, диаметр частиц, скорость обтекания и т.д., различают кинетическую и диффузионную области горения. Рассмотрим зависимость скорости процесса горения от температуры процесса и диаметра частиц (δ).

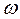
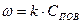
|
|
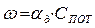
|
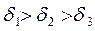
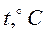
Рис. 18 Области горения
При низких температурах (t<1000°С), скорость процесса горения ограничивается кинетическим или химическим сопротивлением процесса горения. Определяющим фактором скорости процесса является температура. Область горения называется кинетической – (II).
В области (t>1400°C) скорость реакции горения ограничивается скоростью подвода кислорода. Данная область называется диффузионной (I)
В диапазоне температур 1000-14000С - область III на скорость влияют оба фактора (температура процесса горения и скорость подвода кислорода). Данная область называется промежуточной –(III).
Горение жидкого топлива
При горении жидкого топлива температура воспламенения и горения выше температуры кипения отдельных его фракций, поэтому жидкое топливо вначале испаряется, а затем сгорание паров смеси с воздухом происходит при одном агрегатном состоянии. Скорость горения определяется скоростью испарения капель мазута, которая зависит от качества распыла и от скорости подвода кислорода. Снижение диаметра капель ведет к увеличению поверхности испарения, повышению температуры процесса, усилению теплообмена. Горение паров жидкого топлива происходит в диффузионной области. При недостатке кислорода наблюдается термический крекинг, т.е. образование тяжелых углеводородов в виде мельчайших частиц углерода (сажи), что снижает полноту сгорания топлива.
Условия повышения интенсивности сжигания жидкого топлива:
1. предварительный подогрев;
2. тонкое распыливание;
3. подвод воздуха в ядро факела;
4. хорошие условия перемешивания;
5. поддерживание температуры в ядре факела выше 550°С.
 2015-04-30
2015-04-30 1701
1701
