Горение – это реакция соединения горючих элементов топлива (H, C, S) с окислителем.
Горение называют химически полным, если в результате процесса горения образуются продукты полного окисления.
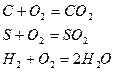
При отсутствии избыточного кислорода состав продуктов сгорания при полном горении выражается уравнением:
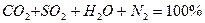
Если в процессе горения образуются газообразные продукты неполного окисления (CO, H  и др.), то горение называется химически неполным.
и др.), то горение называется химически неполным.
Теоретически необходимым количеством воздуха (V0) называется объем воздуха при нормальных условиях, который требуется для полного сгорания единицы топлива 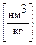 или
или 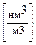 .
.
Для определения данной величины V0 запишем стехиометрические химические реакции горения.
Для твердого и жидкого топлива, состав которых выражается в процентах веса, эти реакции (стехиометрические соотношения) имеют вид:
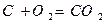
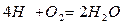
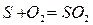
12кг+32кг=44кг 4кг+32кг=36кг 32кг+32кг=64кг или
1кг+ 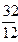 кг=
кг= 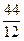 кг 1кг+8кг=9кг 1кг+1кг=2кг
кг 1кг+8кг=9кг 1кг+1кг=2кг
Согласно закону сохранения масс (где 12, 32, 44 и т.д. – атомарные и молекулярные веса реагирующих веществ и продуктов реакций.
На основании вышеприведенных реакций и учитывая, что воздух содержит 21% кислорода по объёму, получим:
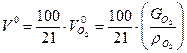 , где
, где 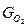
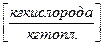 - вес О2 для окисления 1кг топлива
- вес О2 для окисления 1кг топлива
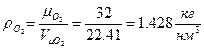 - плотность кислорода при нормальных условиях (
- плотность кислорода при нормальных условиях (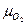 - молекулярный вес О2,
- молекулярный вес О2, 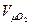 - объём 1 кмоля идеального газа при н.у.)
- объём 1 кмоля идеального газа при н.у.)
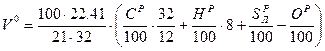
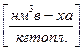 .
.
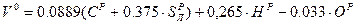
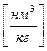
Для газообразного топлива состав выражается в процентах объема. Запишем стехиометрические соотношения процесса окисления горючих компонентов газообразного топлива, учитывая, что 1 кмоль любого газа при нормальных условиях занимает один и тот же объем (22,41 нм3/кмоль). Закона сохранения объёма не существует.
2H 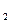 +O
+O 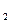 =2H
=2H 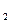 O; 2CO + O
O; 2CO + O 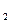 = 2CO
= 2CO 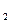 ; CH
; CH 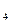 +2O
+2O 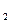 =CO
=CO 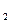 +2H
+2H 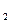 O
O
2м 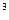 1м3 2м3 2м3 1м3 2м3 1м3 2м3 1м3 2м3
1м3 2м3 2м3 1м3 2м3 1м3 2м3 1м3 2м3
1м3 0.5м3 1м3 1м3 2м3 1м3
2H 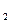 S+3O
S+3O 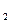 =2H
=2H 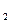 O+2SO
O+2SO 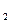
2м3 3м3 2м3 2м3
1м3 1.5м3 1м3 1м3
Таким образом, теоретически необходимый объем воздуха для сжигания газ. топлива
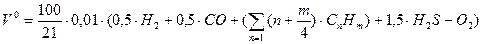
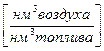 ,
,
где H 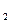 , CO … - в процентах объема.
, CO … - в процентах объема.
 2015-04-30
2015-04-30 4886
4886








