Физическими называют такие явления, при которых не происходит превращений одних веществ в другие, а меняются их агрегатные состояния, форма и размеры тел.
Примеры: плавление льда, вытягивание проволоки, измельчение гранита, испарение воды.
Химическими называют такие явления, при которых происходит превращения одних веществ в другие.
Примеры: горение дров, почернение меди,ржавление железа.
4Р+5О2 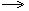 2Р2О5 Признаки и условия протекания химических реакций 2Р2О5 Признаки и условия протекания химических реакций |
В дальнейшем химические явления мы будем называть химическими реакциями.
Признаки химических реакций. По ним можно судить, прошла ли химическая реакция между реагентами или нет. К таким признакам принято относить следующие:
· Изменение цвета: CuSO4 (голубой) = Cu2++ SO42-
· Выпадение осадка: CO2 + Ca(OH)2 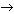 CaCO3
CaCO3 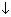 + H2O
+ H2O
· Выделение газа: СаСО3 + HCl 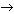 CaCl2 + CO2
CaCl2 + CO2  + H2O
+ H2O
· Образование слабодиссоциированных веществ: 2NaOH+H2SO4 = Na2SO4+2H2O
· Выделение энергии (тепловой или световой): 2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
| Условия протекания |
1. Тесное соприкосновение реагирующих веществ (необходимо): H2SO4 + Zn = ZnSO4 + H2↑ 2. Нагревание (возможно) а) для начала реакции 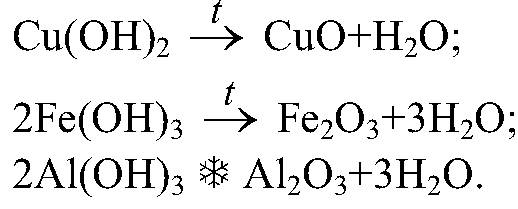 б) постоянно Классификация химических реакций по различным признакам 1.По наличию границы раздела фаз все химические реакции подразделяются на гомогенные и гетерогенные Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией. Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной химической реакцией. В многостадийной химической реакции некоторые стадии могут быть гомогенными, а другие — гетерогенными. Такие реакции называются гомогенно-гетерогенными [1]. В зависимости числа фаз, которые образуют исходные вещества и продукты реакции, химические процессы могут быть гомофазными (исходные вещества и продукты находятся в пределах одной фазы) и гетерофазными (исходные вещества и продукты образуют несколько фаз). Гомо- и гетерофазность реакции не связана с тем, является ли реакция гомо- или гетерогенной[2]. Поэтому можно выделить четыре типа процессов: • Гомогенные реакции (гомофазные). В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе. Примером таких реакций могут служить реакции ионного обмена, например, нейтрализация раствора кислоты раствором щёлочи: б) постоянно Классификация химических реакций по различным признакам 1.По наличию границы раздела фаз все химические реакции подразделяются на гомогенные и гетерогенные Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией. Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной химической реакцией. В многостадийной химической реакции некоторые стадии могут быть гомогенными, а другие — гетерогенными. Такие реакции называются гомогенно-гетерогенными [1]. В зависимости числа фаз, которые образуют исходные вещества и продукты реакции, химические процессы могут быть гомофазными (исходные вещества и продукты находятся в пределах одной фазы) и гетерофазными (исходные вещества и продукты образуют несколько фаз). Гомо- и гетерофазность реакции не связана с тем, является ли реакция гомо- или гетерогенной[2]. Поэтому можно выделить четыре типа процессов: • Гомогенные реакции (гомофазные). В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе. Примером таких реакций могут служить реакции ионного обмена, например, нейтрализация раствора кислоты раствором щёлочи: 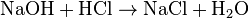 • Гетерогенные гомофазные реакции. Компоненты находятся в пределах одной фазы, однако реакция протекает на границе раздела фаз, например, на поверхности катализатора. Примером может быть гидрирование этилена на никелевом катализаторе: • Гетерогенные гомофазные реакции. Компоненты находятся в пределах одной фазы, однако реакция протекает на границе раздела фаз, например, на поверхности катализатора. Примером может быть гидрирование этилена на никелевом катализаторе: 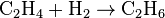 • Гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют в пределах нескольких фаз, однако реакция протекает в одной фазе. Так может проходить окисление углеводородов в жидкой фазе газообразным кислородом. • Гетерогенные гетерофазные реакции. В этом случае реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз. Примером может служить реакция солей угольной кислоты (карбонатов) с кислотами Бренстеда: • Гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют в пределах нескольких фаз, однако реакция протекает в одной фазе. Так может проходить окисление углеводородов в жидкой фазе газообразным кислородом. • Гетерогенные гетерофазные реакции. В этом случае реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз. Примером может служить реакция солей угольной кислоты (карбонатов) с кислотами Бренстеда: 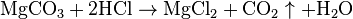 2.По изменению степеней окисления реагентов[править | править вики-текст] В данном случае различают • Окислительно-восстановительные реакции, в которых атомы одного элемента (окислителя) восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления. Частным случаем окислительно-восстановительных реакций являются реакции конпропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления. Пример окислительно-восстановительной реакции — горение водорода (восстановитель) в кислороде (окислитель) с образованием воды: 2.По изменению степеней окисления реагентов[править | править вики-текст] В данном случае различают • Окислительно-восстановительные реакции, в которых атомы одного элемента (окислителя) восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления. Частным случаем окислительно-восстановительных реакций являются реакции конпропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления. Пример окислительно-восстановительной реакции — горение водорода (восстановитель) в кислороде (окислитель) с образованием воды: 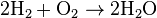 Пример реакции конпропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония: Пример реакции конпропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония: 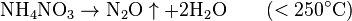 Не относятся к окислительно-восстановительным реакции, в которых не происходит изменения степеней окисления атомов, например: Не относятся к окислительно-восстановительным реакции, в которых не происходит изменения степеней окисления атомов, например:  3.По тепловому эффекту реакции Все химические реакции сопровождаются выделением или поглощением энергии. При разрыве химических связей в реагентах выделяется энергия, которая в основном идёт на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить: • экзотермические реакции, которые идут с выделением тепла, (положительный тепловой эффект) СН4 + 2О2 = СО2 + 2Н2О + энергия (свет, тепло); СаО + Н2О = Са(ОН)2 + энергия (тепло). • эндотермические реакции в ходе которых тепло поглощается (отрицательный тепловой эффект) из окружающей среды. Са(ОН)2 + энергия (тепло) = СаО + Н2О Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH < 0) наблюдается выделение тепла, в противном случае (ΔrH > 0) — поглощение. 4.По типу превращений реагирующих частиц[править | править вики-текст] • соединения: 3.По тепловому эффекту реакции Все химические реакции сопровождаются выделением или поглощением энергии. При разрыве химических связей в реагентах выделяется энергия, которая в основном идёт на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить: • экзотермические реакции, которые идут с выделением тепла, (положительный тепловой эффект) СН4 + 2О2 = СО2 + 2Н2О + энергия (свет, тепло); СаО + Н2О = Са(ОН)2 + энергия (тепло). • эндотермические реакции в ходе которых тепло поглощается (отрицательный тепловой эффект) из окружающей среды. Са(ОН)2 + энергия (тепло) = СаО + Н2О Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH < 0) наблюдается выделение тепла, в противном случае (ΔrH > 0) — поглощение. 4.По типу превращений реагирующих частиц[править | править вики-текст] • соединения: 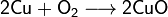 • разложения: • разложения: 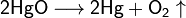 • замещения: • замещения: 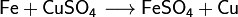 • обмена (в т.ч. тип реакции-нейтрализация): • обмена (в т.ч. тип реакции-нейтрализация): 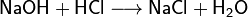 Химические реакции всегда сопровождаются физическими эффектами: поглощением или выделением энергии, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций. Реакция соединения -химическая реакция, в результате которой из двух или большего числа исходных веществ образуется только одно новое.В такие реакции могут вступать как простые, так и сложные вещества. Реакция разложения -химическая реакция, в результате которой из одного вещества образуется несколько новых веществ. В реакции данного типа вступают только сложные соединения, а их продуктами могут быть как сложные, так и простые вещества Реакция замещения -химическая реакция,в результате которой атомы одного элемента, входящие в состав простого вещества, замещают атомы другого элемента в его сложном соединении. Как следует из определения, в таких реакциях одно из исходных веществ должно быть простым, а другое сложным. Реакции обмена - реакция, в результате которой два сложных вещества обмениваются своими составными частями 5.По признаку направления протекания химические реакции делятся на необратимые и обратимые Необратимыми Химические реакции всегда сопровождаются физическими эффектами: поглощением или выделением энергии, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций. Реакция соединения -химическая реакция, в результате которой из двух или большего числа исходных веществ образуется только одно новое.В такие реакции могут вступать как простые, так и сложные вещества. Реакция разложения -химическая реакция, в результате которой из одного вещества образуется несколько новых веществ. В реакции данного типа вступают только сложные соединения, а их продуктами могут быть как сложные, так и простые вещества Реакция замещения -химическая реакция,в результате которой атомы одного элемента, входящие в состав простого вещества, замещают атомы другого элемента в его сложном соединении. Как следует из определения, в таких реакциях одно из исходных веществ должно быть простым, а другое сложным. Реакции обмена - реакция, в результате которой два сложных вещества обмениваются своими составными частями 5.По признаку направления протекания химические реакции делятся на необратимые и обратимые Необратимыми 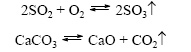 называют химические реакции, протекающие лишь в одном направлении(" слева направо "), в результате чего исходные вещества превращаются в продукты реакции. О таких химических процессах говорят, что они протекают "до конца".К ним относят реакции горения, а также реакции, сопровождающиеся образованием малорастворимых или газообразных веществ Обратимыми называют химические реакции, протекающие лишь в одном направлении(" слева направо "), в результате чего исходные вещества превращаются в продукты реакции. О таких химических процессах говорят, что они протекают "до конца".К ним относят реакции горения, а также реакции, сопровождающиеся образованием малорастворимых или газообразных веществ Обратимыми 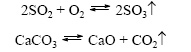 называются химические реакции, протекающие одновременно в двух противоположных направлениях("слева направо" и "справа налево").В уравнениях таких реакций знак равенства заменяется двумя противоположно направленными стрелками.Среди двух одновременно протекающих реакций различают прямую( протекает "слева направо") и обратную (протекает "справа налево").Поскольку в ходе обратимой реакции исходные вещества одновременно и расходуются и образуются, они не полностью превращаются в продукты реакции.Поэтому об обратимых реакциях говорят, что они протекают "не до конца". В результате всегда образуется смесь исходных веществ и продуктов взаимодействия. 6. По признаку участия катализаторов химические реакции делятся на каталитические и некаталитические Каталитическими2SO2 + O2→ 2SO3 (катализатор V2O5) называют реакции, протекающие в присутствии катализаторов.В уравнениях таких реакций химическую формулу катализатора указывают над знаком равенства или обратимости, иногда вместе с обозначением условий протекания. К реакциям данного типа относятся многие реакции разложения и соединения. Некаталитическими2NO+O2=2NO2 называются многие реакции, протекающие в отсутствие катализаторов.Это, например, реакции обмена и замещения. называются химические реакции, протекающие одновременно в двух противоположных направлениях("слева направо" и "справа налево").В уравнениях таких реакций знак равенства заменяется двумя противоположно направленными стрелками.Среди двух одновременно протекающих реакций различают прямую( протекает "слева направо") и обратную (протекает "справа налево").Поскольку в ходе обратимой реакции исходные вещества одновременно и расходуются и образуются, они не полностью превращаются в продукты реакции.Поэтому об обратимых реакциях говорят, что они протекают "не до конца". В результате всегда образуется смесь исходных веществ и продуктов взаимодействия. 6. По признаку участия катализаторов химические реакции делятся на каталитические и некаталитические Каталитическими2SO2 + O2→ 2SO3 (катализатор V2O5) называют реакции, протекающие в присутствии катализаторов.В уравнениях таких реакций химическую формулу катализатора указывают над знаком равенства или обратимости, иногда вместе с обозначением условий протекания. К реакциям данного типа относятся многие реакции разложения и соединения. Некаталитическими2NO+O2=2NO2 называются многие реакции, протекающие в отсутствие катализаторов.Это, например, реакции обмена и замещения. |
3 Вопрос 3
|
|
|
|
|
|
|
|
|
Развитие представлений о строении вещества:
 2015-05-14
2015-05-14 6287
6287
