Пусть некоторый газ переходит из состояния, определяемого параметрами 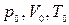 , в состоянии с
, в состоянии с 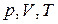 . Указанные параметры связаны равенством
. Указанные параметры связаны равенством
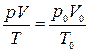 (6)
(6)
Это равенство называют уравнением состояния. Оно принимает простой вид, если массу газа выразить в молях.
Молем называют количество вещества, содержащее столько же структурных элементов, сколько содержится атомов в углероде 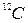 массой 0,012кг.
массой 0,012кг.
Моль любого вещества при нормальных условиях (давление 760 мм. рт. ст. и температура 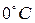 ) занимает одинаковый для всех газов объём – 22,4 литра. Следовательно, для одного моля полученное уравнение (6) имеет вид:
) занимает одинаковый для всех газов объём – 22,4 литра. Следовательно, для одного моля полученное уравнение (6) имеет вид:
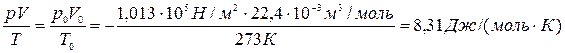
Полученную постоянную величину обозначают буквой R
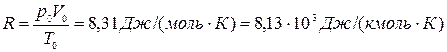
и называют молярной газовой постоянной.
Очевидно, что для 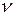 молей газа получим
молей газа получим
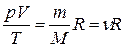 или
или 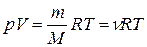 , (7)
, (7)
где т – масса газа;
М – молярная масса данного газа;
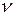 – число молей газа.
– число молей газа.
Это уравнение называют уравнением Клапейрона–Менделеева.
Процессы в газах, протекающие при неизменности какого–либо параметра, называют изопроцессами.
Процесс, протекающий при неизменной температуре, называется изотермическим. Уравнение изотермического процесса (закон Бойля–Мариотта) записывается так:
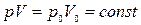 , (8)
, (8)
где 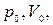
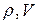 – давление объём данной массы газа в начальной и конечном состояниях.
– давление объём данной массы газа в начальной и конечном состояниях.
Процесс, протекающий при неизменном давлении, называется изобарическим. Уравнение изобарического процесса (закон Гей–Люссака) может быть представлен в виде:
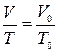 или
или 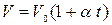 , (9)
, (9)
где 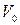 – объём газа при
– объём газа при 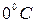 ;
;
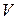 – объём того же газа при температуре Т;
– объём того же газа при температуре Т;
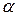 – термический коэффициент объёмного расширения газа, одинаковый для всех газов:
– термический коэффициент объёмного расширения газа, одинаковый для всех газов: 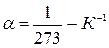 .
.
Величину 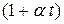 называют биномом объёмного расширения.
называют биномом объёмного расширения.
Процесс, протекающий при неизменном объёме, называется изохорическим. Уравнение изохорического процесса называют уравнением Шарля
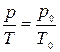 или
или 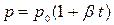 (10)
(10)
где 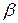 – термический коэффициент давления.
– термический коэффициент давления.
Для идеальных газов, т.е. газов, точно подчиняющихся законам Бойля–Мариотта и Гей–Люссака,
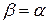 (11)
(11)
На рис. 1 показаны графики изопроцессов в координатах 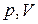 .
.

 2015-05-14
2015-05-14 867
867








