Московский государственный университет
Путей сообщения РФ (МИИТ)
Кафедра «Физика-2»
Группа УПП-141 К работе допущен____________________________
(Дата, подпись преподавателя)
Студент Щеглова Е.А. Работа выполнена____________________________
(ФИО студента) (Дата, подпись преподавателя)
Преподаватель Пыканов И.В. Отчёт принят________________________________ (Дата, подпись преподавателя)
ОТЧЁТ ПО ЛАБОРАТОРНОЙ РАБОТЕ № 11,
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ГАЗА МЕТОДОМ КЛЕМАНА – ДЕЗОРМА.
(Название лабораторной работы)
Цель работы: Определение величины отношения теплоемкости воздуха при постоянном давлении к теплоемкости при постоянном объеме.
 |
Кран
h
Насос Баллон Манометр
Рис.1Лабораторный стенд.
3. Основные теоретические положения к данной работе (основополагающие утверждения: формулы, схематические рисунки):
Первый закон термодинамики утверждает, что количество теплоты D Q, сообщенное газу, расходуется на изменение внутренней энергии газа D U и на работу А, совершаемую газом:
D Q =D U + A.
Теплоемкостью газа называется величина равная количеству теплоты, необходимой для нагревания данной массы газа на один кельвин.
С = lim D Q /D T = dQ / dT.
D T ®0
Теплоемкость единицы массы газа называется удельной теплоем-костью. Теплоемкость одного моля называется молярной теплоемкостью.
Приращение внутренней энергии идеального газаD U, при изменении температуры D Т, определяется выражением:
D U = m / m ´ i /2´ R D T,
где i - число степеней свободы, т.е. число независимых параметров определяющих положение и ориентацию молекулы в пространстве, m - молярная масса газа. Число степеней свободы можно вычислить по формуле
i = 3 N - К,
где N – количество атомов образующих молекулу, а К – число жестких связей между этими атомами.
При постоянном объеме А = 0. В этом случае D Q = D U. Теплоемкость газа при постоянном объеме
C v= 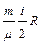 .
.
Работа газа при постоянном давлении
A = p ´ D V = m / m ´ R D T.
Таким образом, теплоемкость газа при постоянном давлении
C p= m / m ´ (i /2 ´ R + R).
Отношение теплоемкостей для данной массы идеального газа зависит от числа атомов в молекуле и определяется числом степеней свободы.
g = C p/ C v= (i + 2) / i. (1)
Приведенная формула верна и для смеси идеальных газов с одинаковым числом степеней свободы.
 2015-05-14
2015-05-14 375
375







