Найдем вначале радиус n-й стационарной орбиты электрона.
При движении электрона по окружности радиуса r ни него действует центростремительная сила mv2/2, в качестве которой выступает сила кулоновского взаимодействия ядра и электрона
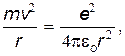
| (26) |
где e — заряд электрона.
Исключая из уравнений (29.24) и (29.26) скорость v, получаем радиус n-й электронной орбиты
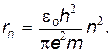
| (27) |
Найдем теперь полную энергию атома водорода:
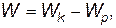
| (28) |
где Wk, Wp — соответственно кинетическая и потенциальная энергия электрона.
Использовав соотношение (29.26), запишем
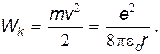
| (29.29) |
Потенциальную энергию электрона найдем как произведение заряда электрона на потенциал электростатического поля, создаваемого ядром:
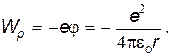
| (30) |
Здесь знак «–» учитывает, что потенциальная энергия взаимодействия электрона и ядра является энергией притяжения.
Подставляя (29.29) и (29.30) в (29.26), получаем полную энергию атома водорода
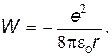
| (31) |
И наконец, подставим в (31) значение радиуса орбитыиз (27):
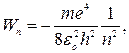
| (32) |
где n=1, 2, ….
Видно, что энергия атома может принимать лишь дискретные значения. Используя второй постулат Бора, найдем частоту фотона, испускаемого при переходе атома водорода из стационарного состояния nбольшей энергией в состояние m с меньшей энергией:
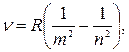
| (29.33) |
где R — постоянная Ридберга;
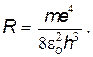
|
Формула (33) совпадает с обобщенной формулой Бальмера (23), установленной экспериментально на основании анализа спектра излучения водорода. В этом спектре различными авторами были выделены серии, в которых положение спектральных линий в шкале частот подчиняется определенным закономерностям. Как следуетиз теории Бора, каждая из серий получается из формулы (33) при определенном фиксированном значении числа т и значениях n, равных m+1, m+2, …:
серия Лаймана
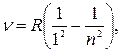 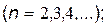
|
серия Бальмера
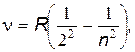 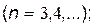
|
серия Пашена
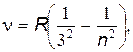 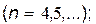
|
серия Брэкета
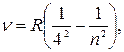 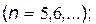
|
серия Пфунда
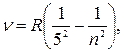 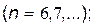
|
Схема переходов, приводящих к возникновению серий в спектре излучения атома водорода, показана на рис, 8. Заметим, что линии серии Лаймана расположены в ультрафиолетовой, серии Бальмера — в видимой, а линии остальных серий — в инфракрасной части спектра,
Объяснение линейчатого спектра излучения и поглощения атома водорода и других водородоподобных атомовНе+, Li+и т.д. являлась блестящим успехом теории Бора. Однако в дальнейшем были обнаружены принципиальные трудности, которые невозможно было преодолеть в рамках этой теории: теория Бора внутренне противоречива: она не была ни последовательно классической, ни последовательно квантовой теорией; она оставляла открытым вопрос об интенсивности спектральных линий; попытки применить эту теорию к многоэлектронным атомам не увенчались успехом.
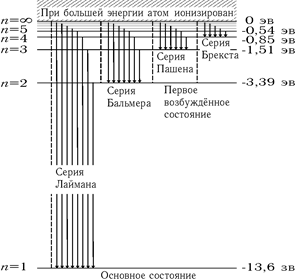
Рис. 8
Тем не менее, в историческом плане теория Бора сыграла свою положительную роль как промежуточный этап на пути к последовательной квантовой теории атомных явлений.
 2015-05-18
2015-05-18 819
819








