Пропустили через растворы антимонита и антимоната натрия ток сероводорода под тягой. При этом осадки не выпали. Подкислили эти растворы и повторили эксперимент – наблюдалось выпадение оранжевого и красного осадка соответственно.
2NaSbO2 + 3H2S + 2HCl = Sb2S3 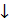 + 2NaCl + 4H2O (оранжевый)
+ 2NaCl + 4H2O (оранжевый)
SbO2- + 3H2S + 2H+ = Sb2S3 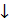 + 4H2O
+ 4H2O
2NaSbO3 + 5H2S + 2HCl = Sb2S5 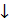 + 2NaCl + 6H2O (тёмно-красный)
+ 2NaCl + 6H2O (тёмно-красный)
SbO3- + 5H2S + 2H+ = Sb2S5 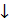 + 6H2O
+ 6H2O
Из уравнений хорошо видно, что в реакции участвуют антимонит и антимонат ионы, а в продуктах ионы сурьмы (III) и (IV). В присутствии ионов водорода осуществляется процесс перехода анионной формы сурьмы в катионную и достижение необходимой концентрации для превышения порога растворимости.
SbO3- + 6H+ 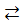 Sb3+ + 3H2O (антимонит)
Sb3+ + 3H2O (антимонит)
SbO5- + 10H+ 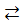 Sb5+ + 5H2O (антимонат)
Sb5+ + 5H2O (антимонат)
Полученные осадки растворимы в сульфиде аммония:
Sb2S3 + 3(NH4)2S = 2(NH4)3SbS3 (тиоантимонит)
Sb2S3 + S2- = 2SbS32-
Sb2S5 + 3(NH4)2S = 2(NH4)3SbS4 (тиоантимонат)
Sb2S5 + S2- = 2SbS42-
При подкислении полученные соли разлагаются:
2(NH4)3SbS3 + 6HCl = Sb2S3 + 6NH4Cl + 3H2S
2SbS32- + 6H+ = Sb2S3 + 3H2S
2(NH4)3SbS4 + 6HCl = Sb2S5 + 6NH4Cl + 3H2S
2SbS42- + 6H+ = Sb2S5 + 3H2S
Вывод. Сурьма образует нерастворимые в воде сульфиды в обоих положительных степенях окисления. Кроме того, она способна к образованию тиосолей: тиоантимоната и тиоантимонита.
 2015-05-10
2015-05-10 2538
2538








