Лабораторная работа № 2. 9.
Цель работы: изучение фазовых переходов I рода на примере плавления-отвердевания кристалла, определение температуры и теплоты плавления, и изменения энтропии в процессе плавления.
Оборудование: печь, трансформатор, реостат.
I. Основные понятия и определения.
Состояние вещества можно охарактеризовать как с механической, так и с термодинамической точек зрения. В первом случае будем различать агрегатные состояния
 вещества по его способности сохранять форму, плотность и т.д., во втором - фазы по термодинамическим параметрам: внутренней энергии, удельному объему и др. Под фазой понимают совокупность всех частей системы, обладающих одинаковым химическим составом, находящихся в одинаковом термодинамическом состоянии и ограниченных поверхностями раздела фаз. Тогда под фазовым переходом будем понимать переход вещества от одного состояния в другое, сопровождающийся скачкообразным изменением его свойств. Если при этом меняются тепловые параметры (внутренняя энергия, теплоёмкость), то это фазовый переход первого рода. При изменении анизотропии, симметрии и т. д. – фазовый переход 2-ого рода.
вещества по его способности сохранять форму, плотность и т.д., во втором - фазы по термодинамическим параметрам: внутренней энергии, удельному объему и др. Под фазой понимают совокупность всех частей системы, обладающих одинаковым химическим составом, находящихся в одинаковом термодинамическом состоянии и ограниченных поверхностями раздела фаз. Тогда под фазовым переходом будем понимать переход вещества от одного состояния в другое, сопровождающийся скачкообразным изменением его свойств. Если при этом меняются тепловые параметры (внутренняя энергия, теплоёмкость), то это фазовый переход первого рода. При изменении анизотропии, симметрии и т. д. – фазовый переход 2-ого рода.
К фазовым переходам первого рода относятся процессы испарения-конденсации жидкости, процессы плавления-отвердевания кристалла. При фазовых переходах 1-ого рода выделяется (конденсация, отвердевание) или поглощается в тех же количествах (испарение, плавление) скрытая теплота перехода Qп.
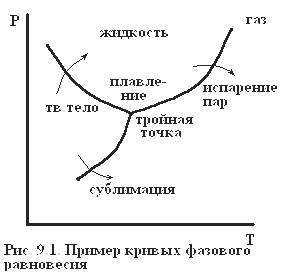
 Примечательной особенностью фазового перехода является то, что в течение всего перехода разные фазы находятся при одинаковых температуре и давлении, пока одна фаза не перейдет в другую. Поэтому на Р-Т диаграмме фазовый переход изображается тонкой. Каждому давлению соответствует своя температура перехода (например: зависимость температуры кипения жидкости от давления) и на Р-Т диаграмме равновесию фаз соответствует кривая фазового равновесия. Равновесие трех фаз осуществляется в точке (тройная точка), являющейся пересечением кривых фазового равновесия разных фаз, как на диаграмме на рис. 9.1. Наклон кривой фазового равновесия на Р-Т диаграмме определяется уравнением Клаузиуса-Клайперона:
Примечательной особенностью фазового перехода является то, что в течение всего перехода разные фазы находятся при одинаковых температуре и давлении, пока одна фаза не перейдет в другую. Поэтому на Р-Т диаграмме фазовый переход изображается тонкой. Каждому давлению соответствует своя температура перехода (например: зависимость температуры кипения жидкости от давления) и на Р-Т диаграмме равновесию фаз соответствует кривая фазового равновесия. Равновесие трех фаз осуществляется в точке (тройная точка), являющейся пересечением кривых фазового равновесия разных фаз, как на диаграмме на рис. 9.1. Наклон кривой фазового равновесия на Р-Т диаграмме определяется уравнением Клаузиуса-Клайперона:
(dP/dT)=Qn/Tn(V2-V1), (1)
где: Qn, Tn- теплота и температура перехода, V2,V1- удельные объемы фаз.
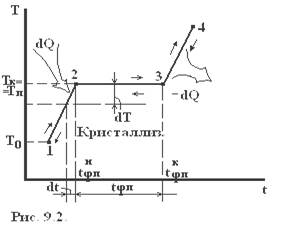
При достаточно сильном нагревании твердого тела можно осуществить его переход из твердого состояния в жидкое – плавление, которое начинается при определенной температуре плавления Тп (рис. 9.2.) и для однокомпонентного кристалла осуществляется при постоянном давлении. Поэтому указанный переход является одновременно изобарным и изотермическим. Обратный процесс охлаждения расплава до некоторой температуры кристаллизации Тк приводит к выделению некоторого количества тепла, равного теплоте плавления, для однокомпонентной жидкости протекает при постоянной температуре плавления. Указанные превращения являются фазовыми переходами 1-ого рода. На каждом линейном участке 1-2 диаграммы плавления системе в течение времени dt сообщается количество тепла dQ от нагревателя, то есть тепловая мощность, передаваемая системе W=dQ/dt. Если m — масса системы, а «c» — её удельная теплоёмкость, то
W=mc(dT/dt). (2)
В процессе плавления система приходит из более упорядоченного кристаллического состояния в менее упорядоченное - жидкое. Поэтому ее энтропия возрастает, причём на основании 2-го начала термодинамики это увеличение:
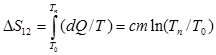 . (3)
. (3)
Плавление на участке 2–3 осуществляется при постоянной температуре Тп поэтому, называя количество тепла, которое необходимо подвести к единице массы тела при Т=const – удельной теплотой плавления r=dQ/dm, получим: W=rm/tфп. При этом приращение энтропии 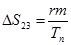 . Преобразуя, получим выражения для удельной теплоты плавления:
. Преобразуя, получим выражения для удельной теплоты плавления:
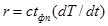 . (4)
. (4)
Полное приращение энтропии до конца процесса плавления:
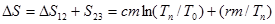 . (5)
. (5)
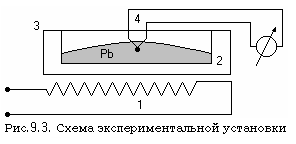
Установка (см. рис. 9.3) состоит из электрического нагревателя 1, в котором вмонтирован тигель 2, заполненный оловом 3. В олово погружена термопара 4, соединенная с измерителем температуры. На схеме установки не показаны отдельные конструктивные элементы, обеспечивающие её метрологические характеристики.
Так как олово массой m0 заключено в тигель массой mТ и теплоёмкости вблизи точки плавления 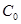 ,
, 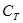 отличаются то формулы (4) и (5) перепишутся следующим образом:
отличаются то формулы (4) и (5) перепишутся следующим образом:
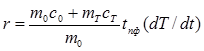 , (6)
, (6)
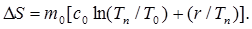 (7)
(7)
III. Проведение эксперимента и обработка результатов.
В эксперименте фиксируется зависимость температуры от времени в процессе плавления и кристаллизации олова. После включения печи через равные интервалы времени (t=15 сек.) регистрируют показания милливольтметра до тех пор, пока не будет зарегистрирован участок 3-4 диаграммы плавления; затем печь отключают и регистрируют диаграмму кристаллизации.
Таблица 9.1.
| N n/n | 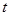 | 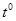 | 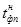 | 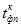 | 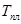 | 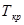 | 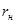 | 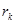 | 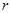 |  |
1. Построить зависимость температуры от времени в процессе плавления и кристаллизации.
2. На построенных зависимостях выделить горизонтальный участок и определить и, температуру плавления Тп и температуру кристаллизации Тк.
3. Вблизи точек 2 и 3 диаграммы плавления и кристаллизации выделить прямолинейный участок, провести через них прямые. Угловой коэффициент прямой  на кривой плавления (рис. 9.4)
на кривой плавления (рис. 9.4) 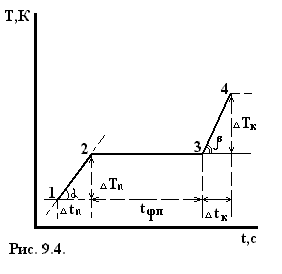 :
:
tg  =
= 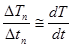
Угловой коэффициент прямой на кривой кристаллизации:
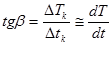 . (9)
. (9)
4. По формуле (6) определить удельную теплоту плавления и кристаллизации:
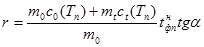 , (10)
, (10)
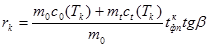 . (11)
. (11)
Для значений удельных теплоёмкостей олова и материала тигеля использовать справочные данные.
5. Вычислить среднее значение 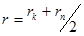 .
.
6. Сравнить табличное и полученное экспериментальное значение.
7. По формуле (7) вычислить приращение энтропии, используя найденное значение r.
Контрольные вопросы.
1. В чём заключается различие агрегатных состояний и фаз?
2. Определите понятие фазы и фазового перехода.
3. В чём различие фазовых переходов 1-ого и 2-ого рода?
4. Как изображаются фазовые переходы и равновесия на Р-Т диаграмме?
5. Что понимается под тройной точкой?
6. В чём заключается смысл ур-я Клаузиуса-Клайперона?
7. В чём особенность зависимости температуры плавления кристалла то времени?
8. Как определить удельную температуру плавления и изменение энтропии из этой зависимости?
9. В чём заключается методика эксперимента, и какой конкретный вид имеют формулы для r и 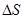 ?
?
10. Какие величины определяются по экспериментальной зависимости Т(t)?
 2015-05-10
2015-05-10 1120
1120