Адсорбцией называется изменение концентрации вещества в поверхностном слое по сравнению с концентрацией внутри фазы.
Если концентрация в поверхностном слое больше, чем внутри фазы, адсорбция называется положительной, если концентрация в поверхностном слое меньше, чем внутри фазы, адсорбция называется отрицательной.
Поверхностная энергия, отнесенная к единице площади (1 м2) поверхности тела, называется поверхностным натяжением (s):
s = F / S.
Вещества адсорбирующиеся из раствора положительно и уменьшающие поверхностное натяжение жидкости, называются поверхностно-активными вещества или ПАВ (органические кислоты, соли, спирты, амины, красители, белковые вещества).
ПАВ представляют собой дифильные молекулы и состоят из двух частей:
1. Полярные группы: -OH, -COOH, -NH2, -SO3H, обладающие сродством к полярной жидкости (вода), называются гидрофильными.
2. Неполярные углеводородные радикалы обладают сродством к неполярным жидкостям (бензол) и называются гидрофобными. Правило Траубе: поверхностная активность веществ на границе раствор – газ увеличивается с увеличением углеводородного радикала в 3.2 раза на группу атомов СН2.
Изменение поверхностного натяжения жидкости связано с адсорбцией вещества на поверхности жидкости (уравнение Гиббса):
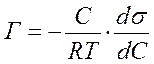 |
где Г – количество молей адсорбируемого вещества на 1 м2 поверхности;
производная ds/ dC – показывает изменение поверхностного натяжения s с изменением концентрации С.
При адсорбции из растворов вещества могут адсорбироваться в виде молекул и ионов. Если вещество адсорбируется в виде молекул, то адсорбция называется молекулярной (неполярной). Если вещество адсорбируется в виде ионов, то адсорбция называется ионной (полярной).
Процесс молекулярной адсорбции описывается уравнением Френдлиха (для средних концентраций):
Где К и 1/n – постоянные величины.
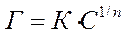 |
Для их определения, прологарифмировав уравнение Френдлиха:
lg Г = lg K + 1/n lg C,
получим уравнение прямой линии, где lg K = ВС – отрезок, отсекаемый прямой линией по оси ординат, а 1/n = tg j = ВС/АВ (тангенс угла наклона прямой).
Полярная или ионная адсорбция имеет место при адсорбции из растворов электролитов. Различают два вида полярной (ионной) адсорбции: обменную и специфическую. При обменной адсорбции процессы поглощения ионов одного знака сопровождаются выходом из адсорбента в раствор ионов того же знака, то есть между адсорбентом и раствором происходит обмен анионами и катионами.
XH + Na+ < = > XNa + H+
Изучение процесса катионного обмена на различных адсорбентах дало возможность сформулировать следующие закономерности:
1. Адсорбция катионов увеличивается с увеличением валентности
2. Для катионов одинаковой валентности адсорбция увеличивается с увеличением радиуса иона.
Так, например, для щелочных и щелочноземельных металлов получается следующий лиотропный по величине адсорбции:
Li+ < Na+ < K+ < Rb+ < Cs+; Mg2+ < Ca2+ < Sr2+ < Ba2+ < Ra2+.
 2015-05-13
2015-05-13 617
617








