Расположите соли в порядке увеличения степени их гидролиза при одинаковой температуре и концентрации растворов: NH4Cl, K2S, NH4F, MgCl2?
Решение:
Рассчитаем константы гидролиза каждой соли.
1. Хлорид аммония NH4Cl образован слабым основанием NH4OH и сильной кислотой HCl.
КД,О(NH4OH) = 1,76×10–5 [Лурье]. По формуле (5.48):
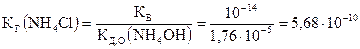 .
.
2. Сульфид калия K2S образован сильным основанием KOH и слабой кислотой H2S.
КД,К,II(H2S) = 1,3×10–13 [Лурье]. По формуле (5.46):
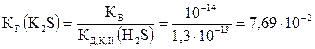 .
.
3. Фторид аммония NH4F образован слабым основанием NH4OH и слабой кислотой HF.
КД,О(NH4OH) = 1,76×10–5; КД,К(HF) = 6,8×10–4 [Лурье]. По формуле (5.52):
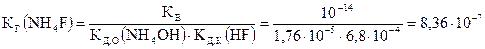 .
.
4. Хлорид магния MgCl2 образован малорастворимым основанием Mg(OH)2 и сильной кислотой HCl.
КД,О,II(Mg(OH)2) = ПР(Mg(OH)2) (см. §5.5) = 1,8×10–11 [Лурье]. По формуле (5.48):
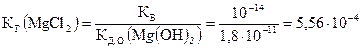 .
.
Ответ: степень гидролиза солей увеличивается в следующем порядке: NH4Cl, NH4F, MgCl2, K2S.
Гидролиз некоторых солей, образованных очень слабыми основаниями и кислотами, является необратимым процессом, например гидролиз сульфидов и карбонатов Al3+, Cr3+, Fe3+. Данные соединения нельзя получить в водном растворе. При взаимодействии солей Al3+, Cr3+, Fe3+ в растворе с сульфидами и карбонатами в осадок выпадают не сульфиды и карбонаты этих катионов, а их гидроксиды. Например, взаимодействие сульфата алюминия Al2(SO4)3 с карбонатом натрия Na2CO3 в воде:
Al2(SO4)3 + 3Na2CO3 + 3HOH ® 2Al(OH)3¯ + 3Na2SO4 + 3CO2,
2Al3+ + 3SO42– + 6Na+ + 3CO32– + 3HOH ® 2Al(OH)3¯ + 6Na+ + 3SO42– + 3CO2,
2Al3+ + 3CO32– + 3HOH ® 2Al(OH)3¯ + 3CO2.
В рассмотренном примере происходит взаимное усиление гидролиза двух солей Al2(SO4)3 и Na2CO3, реакция идёт до конца.
Гидролиз играет важную роль в природных процессах, например – расщепление пищи в желудочно-кишечном тракте идёт по реакции гидролиза её компонентов. Гидролиз используется в технике при получении ценных продуктов из древесины, жиров и других веществ.
 2015-05-26
2015-05-26 1724
1724








