НNО2 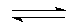 Н+ + NО2-.
Н+ + NО2-.
слабый электролит, К Д= 4,6×10-4
рН = 2,7 Þ при равновесии
[H+] = [NO2 –] = 10-2,7 моль/л, [HNO2] = (с о - 10-2,7) моль/л
К Д HNO2 = [H+] [NO2–]/ [HNO2] Þ
4,6×10-4 = 10-2,7×10-2,7 / (с о – 10-2,7)
Þ с о =0,00214 моль/л.
ЗАДАЧА. Рассчитайте, как изменится рН 0,05 М раствора КОН при введении в него 0,05 моль/л КCl.
Решение.
Расчет рН раствора чистой щелочи.
Сильный электролит:
КОН ® К+ + ОН-
с , моль/л: 0,05 0,05 0,05
I = 1/2(0,05×12 + 0,05×12) = 0,05,
Þ g = 0,85 (по табл. или формуле).
а ОН- = gОН-∙ с OH- = 0,85×0,05 = 0,043
рОН = – lg а ОН- = – lg 0,043 = 1,37.
рН = 14 – 1,37 = 12,63.
Расчет рН после добавления соли.
Соль – сильный электролит:
КСl ® К+ + Сl-
с , моль/л: 0,05 0,05 0,05
I = 1/2å сi∙zi 2 = 1/2 (с ОН- z OH-2+ c Na+ z Na+2+ c Cl- z Cl-2+ c K+ z K+2) = 0,1.
Þ gОН- = 0,8, рОН = – lg 0,8×0,05 = – lg 0,04 = 1,4.
рН = 14 – 1,4 = 12,6.
! а ОН-↓ Þ рН ↓ с 12,63 до 12,6.
ЗАДАЧА. Рассчитайте концентрацию основания Ва(ОН)2 в растворе с рН = 11,3; gОН- = 0,965.
Решение. Ва(ОН)2 - щелочь, сильный электролит:
Ва(ОН)2 ® Ва2+ + 2ОН-
с , моль/л: с о с о 2 с о
рОН = 14 - 11,3 = 2,7 Þ а ОН- = 10-2,7 моль/л.
а ОН- = gОН--∙ с OH- Þ с OH- = 10-2,7/0,965 = 0,002 моль/л.
|
|
|
с (Ba(OH)2)= с OH- /2 = 0,002/2 = 0,001 моль/л.
 2015-05-26
2015-05-26 826
826







