Для выполнения работы методом последовательного разведения готовят ряд растворов слабой кислоты (муравьиной, уксусной, пропионовой, аскорбиновой или другой по указанию преподавателя) различной концентрации: 0,2М; 0,1М; 0,05М; 0,01М; 0,005М.
Исходным раствором служит 2М раствор электролита (либо более концентрированный).
Растворы готовят в мерных колбах на 100мл.
Для этого рассчитывают объем V1 исходного раствора кислоты с молярной концентрацией C1, необходимый для приготовления объема V2 раствора заданной концентрации С2. При расчете исходят из того, что количество кислоты при разбавлении исходного раствора не изменяется:
C1 ·V1 = С2 ·V2.
V1 = С2 ·V2 / C1.
Например, для приготовления 100мл 0,05М раствора необходимо взять 25 мл исходного раствора: V1 = 0,05·100/0,2 = 25 мл.
Измеряют рН приготовленных растворов с помощью рН-метра.
Для получения более точных результатов концентрации приготовленных растворов устанавливают кислотно-основным титрованием (титруют раствором щелочи соответствующей концентрации).
Для титрования выбирают раствор щелочи с концентрацией, примерно равной концентрации титруемого раствора.
СН к = (СН NаОН ∙VNаОН)/ VК ,
где СН NаОН – эквивалентная (нормальная) концентрация щелочи, моль/л;
СН к – эквивалентная (нормальная) концентрация кислоты, моль/л;
VNаОН – средний объем щелочи, пошедший на титрование пробы кислоты, мл;
VК – объем пробы кислоты, мл.
Для одноосновных кислот эквивалентные и молярные концентрации совпадают СН = СМ.
Результаты титрования заносят в таблицу 1.
Таблица 1 − Результаты титрования
| № п/п | Заданная концен-трация раствора, моль/л | Концен- трация щелочи, моль/л | Объем пробы, мл | Объем щелочи, пошедший на титрование | Средний объем щелочи, мл | Точная концен- трация кислоты, моль/л |
Результаты измерений pH и расчетов оформляют в виде таблицы 2.
Рассчитывают аH+. = 10–рН. Принимая, что aH+. = СН+, рассчитывают степень диссоциации кислоты при различных концентрациях: α = СH+/СМ.
Таблица 2 – Экспериментальные результаты по изучению слабого электролита
| № п/п | Концентрация раствора, моль/л | рН | СH+, моль/л | α | α 2/(1– α) | КДИС | lgCM | 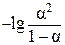 |
Затем рассчитывают КДИС.:
КДИС = 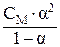 .
.
По данным таблицы 2 рассчитывают среднее значение КДИС. Сравнивают его со значением из таблицы Приложения «Константы диссоциации слабых кислот и оснований при 25°C» [2], вычисляют абсолютную (∆) и относительную (δ) погрешность определения КДИС.
∆ = | КДИС(ТАБЛ) – КДИС(ЭКСП) |;
Δ = 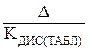 ·100%.
·100%.
По результатам измерений строят два графика: α = f(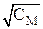 ) (рис.1) и график для определения КДИС (рис.2).
) (рис.1) и график для определения КДИС (рис.2).
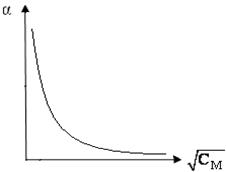
Рис.1 – Зависимость степени диссоциации слабой кислоты α от 
Логарифмируя закон разбавления Оствальда, получим:
1gКДИС = lgCM + lg[α 2/(1 – α)];
– lg[α 2/(1 – α)] = lgСМ – α lgКДИС;
– lg[α 2/(1 – α)] = lgСМ + рК.
Построив график в координатах – lg[α 2/(1– α)] – lgCM, определяют рК как отрезок, отсекаемый прямой линией на оси ординат.
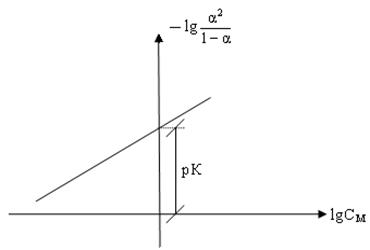
Рис.2 – График для определения рК
Значение константы диссоциации вычисляют как КДИС = 10−pK.
Полученное графическим методом значение константы КДИС сравнивают с табличным значением, вычисляют абсолютную и относительную погрешность ее определения.
 2015-05-26
2015-05-26 736
736








