Пример 1. Рассчитать рН 0,01М раствора соляной кислоты.
Для разбавленных растворов сильных электролитов принимаем a=1, g=1 и а=с. Тогда:
[H+] = CHCl = 0,01 моль/л
рН = - lg 0,01 = 2.
Пример 2. Рассчитать рН 0,01М раствора гидроксида аммония.
(Кв=1,8×10-5).
Гидроксид аммония диссоциирует по уравнению:
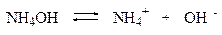
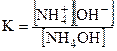
Согласно уравнению диссоциации:
[NH4+]=[OH-]
Так как Кв очень мала, то можно считать, что равновесная концентрация молекул, не распавшихся на ионы, равна исходной концентрации гидроксида аммония. Тогда:
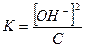
[OH-] = 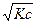 =
= 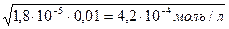
Используя ионное произведение воды, вычисляем концентрацию ионов водорода и рН раствора:
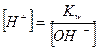 =
= 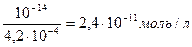
pH = - lg [H+] = -lg 2,4×10-11= 10,6
 2015-05-26
2015-05-26 2554
2554








