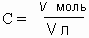
Единица молярной концентрации – моль/л. Зная число молей вещества в 1 л раствора, легко отмерить нужное количество молей для реакции с помощью подходящей мерной посуды.
В качестве примера рассмотрим получение нерастворимого в воде хлорида серебра (AgCl) с помощью реакции обмена:
AgNO3 + NaCl = AgCl (осадок) + NaNO3
Кстати, не нужно запоминать, какие соли растворимы, а какие нерастворимы в воде. Для этого существует таблица растворимости (теперь она есть и в меню левого окна).
Допустим, в лаборатории имеется раствор
AgNO3
, концентрация которого 1 моль/л. Это означает, что в 1 л такого раствора содержится 1 г/моль нитрата серебра.
По уравнению реакции на 1 г/моль
AgNO3 нужен 1 г/моль NaCl. Следовательно, если мы смешаем одинаковые объемы растворов AgNO3 и NaCl одинаковой концентрации 1 моль/л, то реакция пройдет до конца и в реакционной колбе окажется только раствор нитрата натрия (NaNO3) в воде, а на дно сосуда выпадет осадок хлорида серебра AgCl.
При этом исходных соединений в сосуде не останется.
Но как приготовить для реакции нужный раствор
|
|
|
NaCl
? Для этого существуют специальные мерные колбы (рис. 7-4).
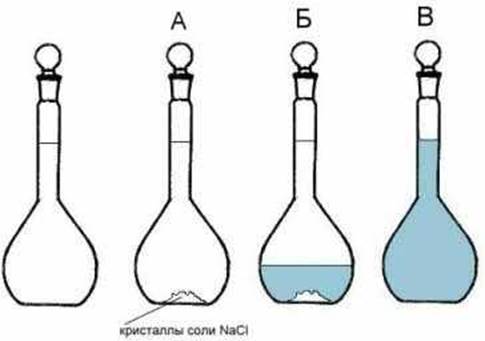
Рис. 7-4. Последовательность приготовления молярного раствора хлорида натрия (1моль/л NaCl). А) В мерную колбу емкостью 1 л помещают навеску кристаллического NaCl. Б) В колбу добавляют немного воды. В) Растворяют кристаллы и доливают раствор дистиллированной водой до метки 1 л, после чего раствор тщательно перемешивают.
Мерная колба представляет собой сосуд с тонкой шейкой, на которой по стеклу нанесена кольцеобразная метка. Если заполнить мерную колбу жидкостью до метки, то ее объем составит ровно 1 л. Возьмем такую колбу и приступим к приготовлению нужного нам раствора NaCl.
Молекулярный вес NaCl составляет (23 + 35,5) = 58,5 а.е.м. Следовательно, молекулярная масса NaCl (1 г/моль) равна 58,5 г. Взвесим это количество NaCl на весах и поместим кристаллы в мерную колбу. Затем добавим немного воды и растворим кристаллы, покачивая колбу. Когда вся соль растворится, дольем раствор водой до метки.
Мерные колбы делают таким образом, что объем раствора достигает точно 1 л, когда водный мениск (уровень воды, слегка изогнутый силами поверхностного натяжения) касается метки своей нижней частью. После этого раствор аккуратно перемешаем.
** Молярную концентрацию (или МОЛЯРНОСТЬ растворов) принято обозначать буквой М. Например, раствор концентрации 1 М содержит 1 моль вещества на литр раствора. Такой раствор называют МОЛЯРНЫМ. Раствор концентрации 0,1 М содержит 0,1 моль вещества на литр раствора и называется ДЕЦИМОЛЯРНЫМ. Растворы концентрации 0,01 М (или 0,01 моль на литр) иногда называют САНТИМОЛЯРНЫМИ.
|
|
|
Итак, мы приготовили раствор NaCl, концентрация которого составляет 1 моль/л, то есть одномолярный или просто молярный раствор.
Молярные концентрации в общем виде иногда обозначают следующим образом:
CNaCl
= 1 моль/л
При смешивании любых равных объемов молярных растворов
AgNO3 и NaCl всегда будет получаться только раствор NaNO3 в воде и осадок AgCl, не содержащие примеси ни одного из исходных реагентов. Отфильтровав осадок и промыв его водой, мы получим чистую соль AgCl (она в воде практически не растворяется). Упарив отфильтрованный раствор, мы получим только чистый нитрат натрия NaNO3. Это не удивительно, потому что смешивая равные объемы растворов, мы берем одинаковое количество молей (или частей моля) реагирующих веществ. В них содержится одинаковое количество молекул AgNO3 и NaCl
, которые реагируют между собой без остатка.
 На фотографии слева показан опыт, который мы обсуждаем. Видно, как при смешивании растворов исходных солей выпадает белый осадок AgCl.
На фотографии слева показан опыт, который мы обсуждаем. Видно, как при смешивании растворов исходных солей выпадает белый осадок AgCl.
Если бы мы взяли не молярные, а, например, 10%-ные
растворы AgNO3 и NaCl (одинаковые объемы), то в них бы содержалось разное число молекул этих веществ и одна из этих солей не израсходовалась бы полностью и осталась в растворе. Какая же из двух солей оказалась бы в избытке? Та, число молей которой больше. Это будет NaCl – соль с меньшим молекулярным весом, поскольку в одинаковой массе солей число более легких молекул (и молей) NaCl
оказывается б о льшим.
Каждый способ выражения концентрации раствора удобен в зависимости от цели, которую преследует химик или технолог. Процентные концентрации более удобны в технике, медицине, экологии. Молярные концентрации чаще встречаются в лабораторной практике.
 2015-06-14
2015-06-14 1044
1044







