В соответствии с теорией молекулярных орбиталей, образование σ- и π-связей в молекуле в общем случае приводит к реализации набора молекулярных орбиталей, характеризующихся различным распределением электронных плотностей между ядрами атомов. Орбитали с максимальной электронной плотностью между атомами обладают меньшей энергией, нежели орбитали с минимальной электронной плотностью. Орбитали с меньшей энергией называют связывающими (σ, π), орбитали с большей энергией - разрыхляющими (σ *, π*). В первую очередь происходит заполнение связывающих орбиталей. Если в молекуле имеются атомы со свободными электронными парами, не принимающими участия в образовании связей, то они находятся на несвязывающей орбитали (n). Энергетические уровни соответствующих орбиталей возрастают в следующем порядке:
σ< π < n < π*< σ*.
Поглощение света молекулой вызывает переход электронов в ней на более высокий энергетический уровень. Вещество будет поглощать свет в видимой части спектра, если возможны переходы электрона под действием электромагнитного излучения соответствующей энергии. Переход σ - σ*, наиболее характерный для насыщенных углеводородов, совершается с поглощением энергии, соответствующей дальней УФ-области спектра. π - π* - переходы, характерные для ненасыщенных органических соединений, требуют меньших энергий. Однако в случае изолированных двойных связей поглощение света происходит в УФ-области, и лишь при наличии сопряжения повышение энергии π - уровня может привести к такому снижению энергии π - π* -перехода, что он будет происходить под действием света видимой части спектра. Удлинение системы сопряжения вызывает батохромный эффект.
|
|
|
В гетероорганических соединениях неподеленные электроны азота, кислорода, серы способны к π - π*- и π - σ *-переходам, требующим сравнительно малых энергий. По этой причине большинство гетероорганических соединений поглощают свет в видимой и ближней УФ-области.
Присоединение к системе сопряжения поляризующих заместителей, смещающих σ -электроны в невозбужденном состоянии по цепи сопряжения, приводит к снижению энергии π - π*- перехода и вызывает батохромный эффект (рисунок 18). Такие заместители могут быть электронодонорными (например, -ОН, NH2, -SH) и электроноакцепторными (например, -NO2, -NO, >C=O). Введение в молекулу таких заместителей кроме смещения полосы поглощения в длинноволновую область вызывает также и повышение максимума абсорбции света (гиперхромный эффект).Причиной батохромного эффекта является и образование комплексных и внутрикомплексных соединений красителей с металлами. Реакции комплексообразования оксиантрахинонов (ализарина, пурпурина) с ионами трехвалентных (Al, Fe, Сг) и двухвалентных (Са, Ва, Со) металлов лежат в основе получения крапплаков. Внедрение в комплекс трехвалентного металла дает возможность варьировать цвет пигмента. Комплексообразование имеет место при получении фталоцианиновых и азопигментов.
|
|
|


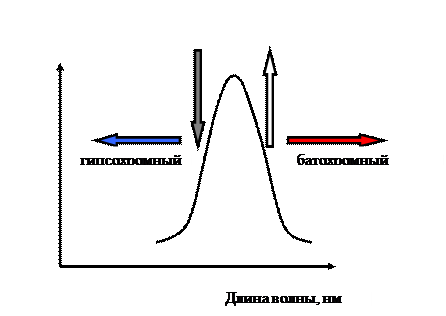
Рисунок –Смещения спектра отражения
На цвет органических соединений оказывают влияние и пространственные факторы. Так, искажение формы молекулы (углов между направлениями связей) повышает энергетический уровень молекулы в основном состоянии, снижает энергию перехода в возбужденное состояние и вызывает тем самым батохромный эффект. Однако, если возможен поворот одной части молекулы относительно другой, и введение какого-либо заместителя нарушает плоскостную структуру молекулы красителя, то это приводит к гипохромному эффектуиз-за разобщения отдельных участков цепи сопряжения [2,7].
 2015-06-14
2015-06-14 1288
1288








