При трактовке явлений адгезии (химический механизм) плодотворной является теория кислот и оснований.
В наше время наиболее распространенными являются три теории кислоты и оснований, которые не противоречат друг другу, а наоборот дополняют.
- Теория сольвосистем.
В соответствии с данной теорией кислота – это такое соединение, которое дает положительные ионы, образуются которые при собственной диссоциации растворителя (Н3О+, NH4+). Положительная сторона данного определения в том, что оно не привязано к водным растворам.
- Протонная теория кислот и оснований.
В соответствии с данной теорией кислоты – это водородсодержащие вещества, которые при реакциях отдают положительные ионы водорода – протоны. Недостаток теории в том, что она не включает в себя вещества, не содержащие водорода проявляющие кислотные свойства – апротонные кислоты.
- Электронная теория была предложена Льюисом в 1923 г. В соответствии с данной теорией кислота – это принимающее электронные пары вещество, т.е. акцептор электронных пар. Согласно теории Льюиса кислотой могут быть и молекула, и катион, с низкой по энергии свободной молекулярной орбиталью.
|
|
|
- Пирсон ввел понятие жестких и мягких кислот и оснований, тем самым модифицировав теорию Льюиса с учетом характеристик орбиталей-акцепторов (принцип Пирсона или принцип ЖМКО).
Принцип ЖМКО: кислотно-основные взаимодействия протекают таким образом, что "жесткие" кислоты предпочтительно связываются с "жесткими" основаниями, а "мягкие" кислоты - с "мягкими" основаниями. При оценке "жесткости" и "мягкости" кислот и оснований учитывают их хим. состав и электронное строение, а также сравнительную устойчивость образуемых ими кислотно-основных комплексов:
А +:В → А: В,
где А - кислота Льюиса,
:В - основание,
А: В - кислотно-основной комплекс.
"Жесткие" кислоты - акцепторы с низкой поляризуемостью, высокой электроотрицательностью, трудно восстанавливаются, их незаполненные граничные орбитали имеют низкую энергию;
"мягкие" кислоты - акцепторы с высокой поляризуемостью, низкой электроотрицательностью, легко восстанавливаются, их своб. граничные орбитали имеют высокую энергию.
"Жесткие" основания - доноры с низкой поляризуемостью, высокой электроотрицательностью, трудно окисляются, их занятые граничные орбитали имеют низкую энергию;
"мягкие" основания доноры с высокой поляризуемостью, низкой электроотрицательностью, легко окисляются, их занятые граничные орбитали имеют высокую энергию.
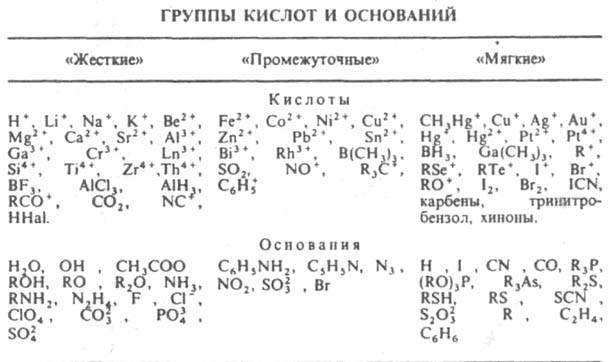
Предпочтительное связывание "жестко-жестких" и "мягко-мягких" реагентов в рамках теории возмущения объясняется тем, что взаимод. между орбиталями с близкой энергией более эффективно, чем между орбиталями, разнящимися по энергии, т. е. подчеркивается преимущество электростатич. ("жестко-жесткого") или ковалентного ("мягко-мягкого") взаимодействия.
|
|
|
Силу кислот и оснований оценивают значением функции кислотности Гаммета Но:
Но =-lg(аfВ/fА),
где а — активность протона для кислоты Бренстеда, или активности кислоты Льюиса;
f В и f А — коэффициент активности адсорбированного основания и сопряженной ему кислоты.
 2015-06-14
2015-06-14 471
471








